Na temat witaminy C krąży bardzo wiele mitów i przekłamań. A ponieważ mają one w dużym stopniu oparcie w chemii, warto jest je tutaj szczegółowo rozjaśnić. Czy zatem może być tak, że witamina może być prawa i lewa? Może i to w dodatku na bardzo różne sposoby.
Kwas askorbinowy to związek szczególny. Jest kofaktorem regulującym działanie wielu enzymów. Pomaga przy produkcji kolagenu, wpływając na stan naczyń krwionośnych i skóry. Jest ważnym przeciwutleniaczem neutralizującym wolne rodniki. A przy tym jest substancją jakiej nasz organizm nie może sam wytwarzać, co zresztą stanowi wśród zwierząt wyjątek. Takie na przykład szczury same go sobie wytwarzają i nigdy nie doznają niedoboru.
Jego brak wywołuje przykre i na dłuższą metę śmiertelne choroby, jak choćby szkorbut, nazywany też obrazowo gnilcem, co zanim poznano jego rolę w żywieniu stanowiło częstą przyczyną zgonów marynarzy, pozbawionych dostępu do świeżej żywności. Nic więc dziwnego, że witamina C została nazwana kwasem a-skorbinowym, to jest antyszkorbutowym.
Człowiek wynalazł kilka prostych sposobów jego syntezy tak, aby otrzymać cząsteczkę o budowie takiej samej jak naturalna. Zwykle surowcem jest cukier glukoza, która zostaje zredukowana wodorem, poddana fermentacji przez bakterie octowe, selektywnie utleniona i odwodniona. W ten sposób, bądź metodami z większym udziałem bakterii, produkuje się ją w ilościach niemal przemysłowych i zużywa głownie jako przeciwutleniacz w żywności, środek zapobiegający brązowieniu mrożonek czy ulepszacz do pieczywa.
Zasadniczo dobrze zbilansowana dieta powinna dostarczać go nam wręcz w nadmiarze, jednak niektórzy wolą go sobie dodatkowo uzupełniać w większych dawkach. I często wpadają w pułapkę marketingu. Specjaliści od suplementów mówią im "Nie kupujcie pigułek w aptece bo w ogóle nie działają, bierzcie wyciąg z X albo tabletki dla których specjalnie potwierdzono że to jest ten właściwy, przypadkiem mamy je w ofercie. Bierz tylko nasze".
Czemu tabletkowa witamina ma nie działać? Bo "prawdziwa" i naturalna jest ta lewoskrętna, więc jeśli na opakowaniu nie zostanie wprost to napisane, to niechybnie tabletki zawierają tą nieczynną prawoskrętną.
Każdy kto ma trochę większe pojęcie o chemii, wie jak zbudowana jest cząsteczka witaminy C i wie o co chodzi z tą skrętnością, czy lewością, uśmieje się słysząc takie rzeczy. Ale niestety przeciętny konsument nie wie. Więc ja mu rzecz krótko wyjaśnię
Asymetria
Asymetria to własność obiektu, która powoduje, że obracając go w przestrzeni, odbijając w wyimaginowanym "lustrze kształtów" czy przekształcając przez punkt nie otrzymamy identycznie wyglądającej bryły. No chyba, że obrócimy go o 360 stopni czy powtórzymy odbicia dwa razy, ale to tak jakbyśmy go z miejsca nie ruszali.
Chemicy już dawno odkryli, że cząsteczki związków chemicznych, będące ułożonymi w przestrzeniami skupiskami atomów, mogą bądź posiadać jakąś symetrię, bądź nie posiadać żadnej, i to właśnie te ostatnie okazały się najciekawsze. Jeśli cząsteczka związku jest asymetryczna, to bardzo często możliwe jest, że mogą istnieć jej dwie formy, podobne do siebie jak lustrzane odbicia ale nie nakładające się na siebie.
Obiektami o takich własnościach z jakimi często mamy do czynienia, są nasze ręce - jedna dłoń jest lustrzanie podobna do drugiej, ale jedna nie nałoży się na kształt drugiej, bo kciuki odchylają się w różne strony. Jeśli złożymy dłonie jak do modlitwy sytuacja będzie podobna, bo w różne strony będą zwrócone ich grzbiety. Z tego powodu matematycy bryły o takich właściwościach, a więc posiadające lustrzanie podobne formy "lewą" i "prawą" jak dłonie, nazwali chiralnymi, od greckiego "chira" to jest ręka. (a wróżenie z dłoni to chiromancja).
Jeśli cząsteczka związku chemicznego nie będzie posiadała elementów symetrii, takich jak środek symetrii, płaszczyzna czy osie inwersyjne, to także i dla niej możliwe będzie dla niej istnienie w dwóch formach, nazywanych izomerami optycznymi. Zazwyczaj dotyczy to związków organicznych, w których atom węgla tworzy cztery wiązania ułożone nie płasko, i wystarczy aby w którymkolwiek z węgli cząsteczki zdarzyło się, że do każdego wiązania będzie przyczepione coś innego.
Aby ten fakt opisać i jakoś odróżniać poza tym we wszystkim identyczne izomery, chemicy stworzyli szereg systemów klasyfikujących
R czy S?
Ten sposób klasyfikacji opiera się na rzeczywistej budowie związku. Aby sprawdzić jaka jest jego konfiguracja, sprowadzamy go do tego właśnie interesującego nas węgla, mającego cztery różne podstawniki, nazywanego asymetrycznym. Podstawnikom tym nadajemy pewne rangi, zależne od stopnia rozbudowania, całkowitej masy atomowej czy obecności cięższych atomów. No i otóż, jeśli ustawimy naszą cząsteczkę tak, że podstawnik najniższej rangi znajdzie się z tyłu, a trzy pozostałe będą skierowane w naszą stronę, to gdy przechodząc od podstawnika ważniejszego do mniej ważnych wykonujemy obrót w prawo, konfiguracja dla tego węgla wynosi R a gdy w lewo wynosi S.
Ten sposób klasyfikacji jest bardzo ścisły, po samej nazwie możemy ustalić jak przestrzennie są poustawiane grupy wokół tego atomu.
W jednej cząsteczce może być zawartych wiele takich atomów, ponieważ zaś każdy ma dwie możliwe konfiguracje, możliwych staje się wiele izomerów. Przykładowo glukoza ma cztery takie atomy o konfiguracji 2R,3S,4R,5R, będąc jednym z 16 możliwych izomerów aldoheksozy. Symetria takich cząsteczek jest bardziej skomplikowana i niekoniecznie chiralna, przykładowo związki w odmianie mezo zawierają asymetryczne atomy węgla ale o przeciwnej konfiguracji, co powoduje że cała cząsteczka nabiera symetrii i nie jest czynna optycznie.
D czy L?
Klasyfikacja D/L jest używana właściwie tylko do cukrów, polialkoholi i aminokwasów, także dla witaminy C. Jest to klasyfikacja względna, w której przypisanie związku do danej kategorii odbywa się poprzez porównanie konfiguracji z pewnym wzorcem.
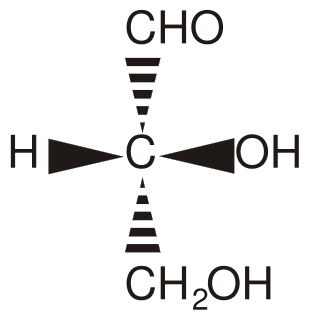
Tą cząsteczką wzorcową był naturalnie występujący aldehyd glicerynowy, uznany z najprostszy przypadek, składał się bowiem z trzech węgli z czym jeden tylko był asymetryczny. Klasyfikacja odbywa się następująco - ustawiamy naszą cząsteczkę aby łańcuch węglowy był ustawiony pionowo, grupa aldehydowa lub ketonowa znalazła się na górze, a grupy boczne sterczały na boki, będąc zwrócone lekko w naszą stronę (co rysuje się w ten sposób, że ich wiązania wyglądają jak czarne trójkąty):
Jeśli w takim ustawieniu grupa -OH znajdzie się po prawej, to cząsteczkę zaliczymy do szeregu D a jeśli po lewej to do szeregu L. Jeśli nasza cząsteczka zawiera więcej węgli asymetrycznych, wtedy bierzemy pod uwagę tylko ten ostatni na dole.
Jak widzicie jest to klasyfikacja bardzo arbitralna.
+ czy -?
Ostatni sposób klasyfikacji nie jest wprost związany z budową cząsteczki, a bardziej z tym jak oddziałuje ze światłem. Otóż izomery geometryczne związków wpływają na światło spolaryzowane. Jeśli przez fiolkę ze związkiem przepuścimy światło spolaryzowane przy pomocy polaryzatora ustawionego w określonym kierunku, to po przejściu przez związek kierunek polaryzacji światła trochę się przekręci. Poznajemy to po tym, że ustawiając za fiolką drugi polaryzator widzimy że część światła z fiolki jest zatrzymywana i aby uzyskać pełną przepuszczalność, musimy drugi polaryzator trochę obrócić.
Obejrzyjcie świetną demonstrację tego zjawiska dla dwóch izomerów karwonu:
.
I teraz najważniejsze. Uznano, że jeśli płaszczyzna polaryzacji obróciła się w prawo, to mówimy o związku że jest prawoskrętny i przypisujemy mu znaczek plus (+) a jeśli w lewo to jest lewoskrętny i przypisujemy mu znaczek minus (-). Dwa izomery optyczne tej samej substancji skręcają światło spolaryzowane o taki sam kąt w przeciwne strony, dlatego zawsze jeden jest (+) a drugi (-). Ich mieszanina pół na pół jest nieaktywna bo przeciwne oddziaływania się znoszą.
Przy czym nie koniecznie znak skręcalności powiązany jest z konfiguracją R/S czy D/L. Wprawdzie dany określony izomer geometryczny ma zawsze dany określony znak skręcalności, ale różne związki o konfiguracji D czy R mogą skręcać światło spolaryzowane w różne strony. Na przykład D-glukoza jest prawoskrętna a D-fruktoza lewoskrętna.
A jaka jest witamina?
Kwas askorbinowy zawiera dwa węgle asymetryczne, w związku z czym możliwe są dla niego cztery izomery; kwas (R,S)-L-askorbinowy, (S,R)-D-askorbinowy; (S,S)-L-izoaskorbinowy i (R,R)-D-izoaskorbinowy
Aktywność biologiczną witaminy ma tylko jeden z nich, występujący naturalnie kwas (R,S) L-askorbinowy. Pozostałe nie mogą być nazywane witaminami, choć są podobnymi do niej przeciwutleniaczami..
A jak wygląda czynność optyczna? Otóż będący witaminą C naturalny kwas L-askorbinowy jest prawoskrętny. Czyli ma znaczek (+).
Zatem specjaliści od wciskania ludziom suplementów, którzy twierdzą, że witamina C powinna być lewoskrętna, pewnie pomylili się widząc znaczek L mówiący o względnej konfiguracji związku. Który to mówi nam jedynie, że jeśli zapiszemy cząsteczkę związku w określony sposób to grupa -OH na ostatnim węglu asymetrycznym będzie po lewej stronie rysunku, a to nie ma nic do skrętności.
...bo jak nie napisali L to na pewno jest D
Gdy świat alternatywnej medycyny pojął wreszcie istnienie dwóch odmian kwasu askorbinowego, zaczął przekonywać, że z pewnością absolutnie ta tabletkowa witamina, to jest właśnie ta nienaturalna D. Ze jeśli nie napiszą "kwas L-askorbinowy" to znaczy, że to musi być ten drugi. Ci którzy się na to nabierają zamawiają w hurtowniach wielkie wory kwasu L, nie ufając tabletkom, no bo przecież kto wie co sobie producenci napisali.
Dlaczego to bzdura?
Jak to już powyżej napisałem, kwas L-askorbinowy produkuje się z naturalnej glukozy otrzymując właściwą "naturalną" konfigurację. Wobec tego związek jest dosyć tani i dlatego bardziej opłaca się pchać go do tabletek, niż drugi izomer, produkowany w mniejszych ilościach przy pomocy innych, bardziej skomplikowanych metod. Kwas D-askorbinowy nie występuje w naturze a organizmy nie są przystosowane do jego wytwarzania, odpada więc bardzo ułatwiający produkcję mikrobiologiczny etap syntezy. Aby go otrzymać należałoby więc albo użyć drogich katalizatorów albo szeregu przemian dających mieszaninę izomerów, którą następnie należałoby rozdzielać. Ponieważ jednak izomer D nie jest wykorzystywany w medycynie, nikt go specjalnie nie produkuje. Czemu więc tabletki miałyby zawierać nie produkowany, znacznie droższy, nieaktywny izomer, gdy w zasięgu jest produkowany na dużą skalę aktywny L-izomer?
Inna kwestia to dozwolone nazewnictwo obu odmian. Nazwa handlowa "witamina C" oraz nazwa "kwas askorbinowy" są na mocy międzynarodowych przepisów zastrzeżone tylko dla kwasu L-(+)-askorbinowego, takiego jak naturalny. Producent nie może wsadzać w preparat inny stereoizomer i nazwać go witaminą. Ponieważ w świetle przepisów jest to w sumie jasne, producent tabletek nie musi pisać na opakowaniu, że tabletka zawiera kwas L-(+)-(4R,5S)-askorbinowy abyśmy byli pewni, że jest to taka cząsteczka jak naturalna, działająca biologicznie.
ps. 03.02 Dowiedziałem się, że w lutowym numerze Wiedzy i Życia także pojawił się artykuł o witaminie C. Jest dużo obszerniejszy i skupia się głównie na zastosowaniach medycznych ale o skrętności też wspomina. Polecam zajrzeć.
informacje
Pokazywanie postów oznaczonych etykietą żywność. Pokaż wszystkie posty
Pokazywanie postów oznaczonych etykietą żywność. Pokaż wszystkie posty
środa, 1 lutego 2017
czwartek, 2 czerwca 2016
Co to jest ksylitol?
Czyli parę tajemnic, o jakich nie powiedzą wam w sklepikach ze zdrową i naturalną żywnością...
Na pomysł tego wpisu naprowadziły mnie pastylki na kaszel. Gdy przeglądałem dostępne w aptece znalazłem też takie, które chwaliły się że nie zawierają cukru. Zajrzałem więc na skład gdzie jako główny środek słodzący wymieniono ksylitol. To, samo w sobie, nie było jeszcze zaskakujące, jednak producent uznał za potrzebne uspokojenie klienta, tak aby nie zaniepokoił się tą trudną nazwą i w nawiasie wyjaśnił "ekstrakt z kory brzozy". I w tym problem, że składnik ten jest akurat takim ekstraktem, jak wódka sokiem...
Zacznijmy może od najbardziej podstawowej rzeczy - ksylitol nie jest cukrem. Więc pisanie wszędzie, we wszystkich reklamach, że to "cukier brzozowy" jest błędem. Na właściwy trop powinna naprowadzać nas już nazwa - końcówka -ol jest właściwa dla alkoholi, i faktycznie, ksylitol należy do grupy alkoholi cukrowych.
Typowy cukier to cząsteczka nasycona będąca łańcuchem węglowodorowym w którym każdy (lub prawie dla cukrów deoksy) węgiel jest przyłączony z grupą -OH, stąd wzór ogólny Cx(H2O)y i nazwa węglowodany, wydaje się bowiem sądząc po tym wzorze, jakby składały się z węgla i wody. Tym co odróżnia je od alkoholi wielohydroksylowych jest obecność grupy aldehydowej lub ketonowej, a więc z podwójnym wiązaniem węgiel-tlen C=O. Grupa ta wpływa na ich reaktywność oraz umożliwia im występowanie w formie pierścieniowej po utworzeniu hemiacetalu.
Jeśli teraz zredukujemy cukier tak, aby także tą grupę aldehydową lub ketonową zamienić w kolejną grupę -OH otrzymamy alkohol polihydroksylowy. Ze zredukowania glukozy powstaje sorbitol, także znany jako środek słodzący, ze zredukowanej mannozy mannitol. Możliwe jest też selektywne redukowanie wielocukrów. Ogółem różnym alkoholom cukrowym poświęcę jakiś osobny wpis, ale teraz zajmę się tym jednym. Natomiast ksylitol to produkt zredukowania ksylozy.
Ksyloza to cukier prosty zawierający pięć atomów węgla; glukoza i fruktoza zawierają ich sześć. W przyrodzie rzadko występuje swobodnie, najczęściej jest składnikiem hemiceluloz, będących budulcem ścian komórkowych roślin. Wiele połączonych cząsteczek ksylozy, czasem też arabinozy, tworzy łańcuchy nie tak długie i silnie połączone jak celuloza, stanowiące raczej spoiwo. Głównym wyróżnikiem jest łatwa rozpuszczalność w rozcieńczonych zasadach, dzięki czemu można je oddzielić od celulozy.
Hemicelulozy są w świecie roślinnym wszechobecne, spotykamy je w tkankach, szczególnie dużo w tych łykowatych i drewniejących. Są też obecne w drewnie zwłaszcza młodych drzew, przy czym im ich więcej tym bardziej jest miękkie i skłonne do pęcznienia, najwięcej bo do 30% zawiera ich drewno brzozy i buka. Aby otrzymać z tkanek ksylozę, najpierw trzeba oddzielić od nich hemicelulozy.
Rozdrobione tkanki roślinne traktuje się rozcieńczonymi zasadami, w których dobrze się rozpuszczają. Następnie zakwasza i poddaje hydrolizie bądź w warunkach silnie kwaśnych, bądź enzymatycznej. Po oczyszczeniu i wykrystalizowaniu otrzymujemy ksylozę. W czasie wojny Finowie pozbawieni dobrych źródeł cukru stosowali jako zamiennik właśnie ksylozę, która wprawdzie nie jest tak bardzo słodka jak cukier stołowy, ale w kraju gdzie burak cukrowy nie urośnie było to zawsze coś.
W Europie zwykle produkuje się ksylozę z drewna, mamy bowiem dość dobre źródła, natomiast na świecie są to łykowate części roślin, zwłaszcza łodygi kukurydzy, ale także wytłoki trzciny cukrowej, słoma z owsa lub ryżu a nawet łuski nasion bawełny. Często ksyloza jest spotykana pod nazwą cukru drzewnego, ale niekoniecznie brzozowego.
No dobra. Mamy już ksylozę. Co zrobić aby otrzymać z niej ksylitol? A no zredukować.
W przemyśle stosuje się głównie uwodornianie na katalizatorze niklowym [1] Robi się też próby z redukcją mikrobiologiczną przy pomocy pewnych gatunków drożdży lub pleśni, ale te nie mają takiego znaczenia.
Jako zamiennik cukru ksylitol ma zbliżoną słodkość do sacharozy i nie ma nieprzyjemnego posmaku, co zaś najważniejsze ma bardzo niski indeks glikemiczny a więc w bardzo małym stopniu przyczynia się do uwalniania insuliny i może być użyty w żywności dla diabetyków.
U niektórych zwierząt wykazuje wręcz przeciwne działanie - podany psom wywołuje na tyle silne wydzielenie insuliny, że może im grozić śmierć z powodu hipoglikemii; wystarczy już dawka rzędu 100 mg/kg psa. Było to dawniej przyczyną problemów z wprowadzeniem na rynek, ale dopiero potem badania pokazały że u ludzi ma zupełnie odmienny metabolizm i nie jest dla nich szkodliwy.
Jest dość wolno wchłaniany z jelita i większość jest przetwarzana przez bakterie jelitowe do krótkołańcuchowych kwasów tłuszczowych. W takiej formie metabolity ksylitolu mogą być wchłaniane i zużywane, w związku z czym wbrew temu co piszą niektóre strony nie jest to związek "bez kalorii"; wartość energetyczna to około 70% kaloryczności glukozy. Słabe wchłanianie w jelitach ma też swoje złe strony, może bowiem w zbyt dużych ilościach wywołać biegunkę osmotyczną, związaną z wydalaniem wody do treści jelit dla wyrównania stężenia, jednak organizm stopniowo adaptuje się do wchłaniania dzięki czemu po pewnym czasie można spożyć nawet kilkadziesiąt gramów bez złych skutków. Ponadto bakterie jelitowe mogą przetwarzać go nazbyt ochoczo doprowadzając do wzdęć.
Jak wykazują badania ze względu na to że nie jest metabolizowany przez bakterie w jamie ustnej nie przyczynia się do rozwoju próchnicy a nawet w pewnym stopniu ją hamuje wpływając na mineralizację szkliwa.
Czym więc nie jest ksylitol? Na pewno nie jest "ekstraktem z kory brzozy" - w tym przypadku producent pojechał po bandzie. Problematyczne są też reklamy opisujące, że jest otrzymywany z brzozy bez uściślenia w jaki sposób. W efekcie wielu ludzi wyobraża sobie, że występuje w drewnie, liściach lub soku i stamtąd jest po prostu wymywany, parę razy widziałem domysły, że krystalizuje się go z soku brzozowego w związku z czym sok taki propaguje się przypisując mu jego właściwości, a nawet domysły, że to po prostu wysuszony sok z brzozy (w rzeczywistości sok brzozy zawiera głownie sacharozę i glukozę[2]). W dodatku producenci skrzętnie omijają w reklamach inne źródła, jak wspomniane łodygi kukurydzy czy słoma owsiana, bo brzoza budzi lepsze skojarzenia, brzmi bardziej dziko i naturalnie.
Inny problem to reklamy opisujące że ksylitol jest składnikiem "występującym w naturze" czy wręcz "naturalnym" - faktycznie, występuje w naturze, szczególnie dużo (ok. 1%) jest go w owocach jagodowych i niektórych warzywach, ale nie stamtąd się go otrzymuje. A akurat ten sprzedawany z sklepach jest otrzymywany z drewna które go nie zawiera po dwuetapowym procesie, więc w najlepszym razie jest produktem półsyntetycznym. Niestety kult naturalności i przekonanie że wszystko co sztuczne musi być złe powodują, że dla większych zysków producenci starają się mniej lub bardziej oszukać klientów.
Jako ciekawostkę dodam na koniec, że po znitrowaniu można z ksylitolu zrobić całkiem niezły materiał wybuchowy. To tak a'propos argumentacji "to musi być złe bo ma złe zastosowania".
-------------
Źródła:
* https://en.wikipedia.org/wiki/Xylitol
* https://www.dcnutrition.com/miscellaneous/Detail.CFM?RecordNumber=695
* http://www.danisco.com/fileadmin/user_upload/danisco/documents/products/2e_XIVIA_White_Paper.pdf
[1] http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0104-66322003000300006
[2] http://luczaj.com/publikacje/2014%20Luczaj%20Bilek%20Stawarczyk.pdf
Polecam obszerny artykuł na temat ksylitolu, nie znalazłem go gdy szukałem informacji do swojego a dużo uzupełnia:
http://pinkcake.blox.pl/2015/02/Ksylitol-bialy-oczyszczony-nienaturalny.html
Na pomysł tego wpisu naprowadziły mnie pastylki na kaszel. Gdy przeglądałem dostępne w aptece znalazłem też takie, które chwaliły się że nie zawierają cukru. Zajrzałem więc na skład gdzie jako główny środek słodzący wymieniono ksylitol. To, samo w sobie, nie było jeszcze zaskakujące, jednak producent uznał za potrzebne uspokojenie klienta, tak aby nie zaniepokoił się tą trudną nazwą i w nawiasie wyjaśnił "ekstrakt z kory brzozy". I w tym problem, że składnik ten jest akurat takim ekstraktem, jak wódka sokiem...
Zacznijmy może od najbardziej podstawowej rzeczy - ksylitol nie jest cukrem. Więc pisanie wszędzie, we wszystkich reklamach, że to "cukier brzozowy" jest błędem. Na właściwy trop powinna naprowadzać nas już nazwa - końcówka -ol jest właściwa dla alkoholi, i faktycznie, ksylitol należy do grupy alkoholi cukrowych.
Typowy cukier to cząsteczka nasycona będąca łańcuchem węglowodorowym w którym każdy (lub prawie dla cukrów deoksy) węgiel jest przyłączony z grupą -OH, stąd wzór ogólny Cx(H2O)y i nazwa węglowodany, wydaje się bowiem sądząc po tym wzorze, jakby składały się z węgla i wody. Tym co odróżnia je od alkoholi wielohydroksylowych jest obecność grupy aldehydowej lub ketonowej, a więc z podwójnym wiązaniem węgiel-tlen C=O. Grupa ta wpływa na ich reaktywność oraz umożliwia im występowanie w formie pierścieniowej po utworzeniu hemiacetalu.
Jeśli teraz zredukujemy cukier tak, aby także tą grupę aldehydową lub ketonową zamienić w kolejną grupę -OH otrzymamy alkohol polihydroksylowy. Ze zredukowania glukozy powstaje sorbitol, także znany jako środek słodzący, ze zredukowanej mannozy mannitol. Możliwe jest też selektywne redukowanie wielocukrów. Ogółem różnym alkoholom cukrowym poświęcę jakiś osobny wpis, ale teraz zajmę się tym jednym. Natomiast ksylitol to produkt zredukowania ksylozy.
Ksyloza to cukier prosty zawierający pięć atomów węgla; glukoza i fruktoza zawierają ich sześć. W przyrodzie rzadko występuje swobodnie, najczęściej jest składnikiem hemiceluloz, będących budulcem ścian komórkowych roślin. Wiele połączonych cząsteczek ksylozy, czasem też arabinozy, tworzy łańcuchy nie tak długie i silnie połączone jak celuloza, stanowiące raczej spoiwo. Głównym wyróżnikiem jest łatwa rozpuszczalność w rozcieńczonych zasadach, dzięki czemu można je oddzielić od celulozy.
Hemicelulozy są w świecie roślinnym wszechobecne, spotykamy je w tkankach, szczególnie dużo w tych łykowatych i drewniejących. Są też obecne w drewnie zwłaszcza młodych drzew, przy czym im ich więcej tym bardziej jest miękkie i skłonne do pęcznienia, najwięcej bo do 30% zawiera ich drewno brzozy i buka. Aby otrzymać z tkanek ksylozę, najpierw trzeba oddzielić od nich hemicelulozy.
Rozdrobione tkanki roślinne traktuje się rozcieńczonymi zasadami, w których dobrze się rozpuszczają. Następnie zakwasza i poddaje hydrolizie bądź w warunkach silnie kwaśnych, bądź enzymatycznej. Po oczyszczeniu i wykrystalizowaniu otrzymujemy ksylozę. W czasie wojny Finowie pozbawieni dobrych źródeł cukru stosowali jako zamiennik właśnie ksylozę, która wprawdzie nie jest tak bardzo słodka jak cukier stołowy, ale w kraju gdzie burak cukrowy nie urośnie było to zawsze coś.
W Europie zwykle produkuje się ksylozę z drewna, mamy bowiem dość dobre źródła, natomiast na świecie są to łykowate części roślin, zwłaszcza łodygi kukurydzy, ale także wytłoki trzciny cukrowej, słoma z owsa lub ryżu a nawet łuski nasion bawełny. Często ksyloza jest spotykana pod nazwą cukru drzewnego, ale niekoniecznie brzozowego.
No dobra. Mamy już ksylozę. Co zrobić aby otrzymać z niej ksylitol? A no zredukować.
W przemyśle stosuje się głównie uwodornianie na katalizatorze niklowym [1] Robi się też próby z redukcją mikrobiologiczną przy pomocy pewnych gatunków drożdży lub pleśni, ale te nie mają takiego znaczenia.
Jako zamiennik cukru ksylitol ma zbliżoną słodkość do sacharozy i nie ma nieprzyjemnego posmaku, co zaś najważniejsze ma bardzo niski indeks glikemiczny a więc w bardzo małym stopniu przyczynia się do uwalniania insuliny i może być użyty w żywności dla diabetyków.
U niektórych zwierząt wykazuje wręcz przeciwne działanie - podany psom wywołuje na tyle silne wydzielenie insuliny, że może im grozić śmierć z powodu hipoglikemii; wystarczy już dawka rzędu 100 mg/kg psa. Było to dawniej przyczyną problemów z wprowadzeniem na rynek, ale dopiero potem badania pokazały że u ludzi ma zupełnie odmienny metabolizm i nie jest dla nich szkodliwy.
Jest dość wolno wchłaniany z jelita i większość jest przetwarzana przez bakterie jelitowe do krótkołańcuchowych kwasów tłuszczowych. W takiej formie metabolity ksylitolu mogą być wchłaniane i zużywane, w związku z czym wbrew temu co piszą niektóre strony nie jest to związek "bez kalorii"; wartość energetyczna to około 70% kaloryczności glukozy. Słabe wchłanianie w jelitach ma też swoje złe strony, może bowiem w zbyt dużych ilościach wywołać biegunkę osmotyczną, związaną z wydalaniem wody do treści jelit dla wyrównania stężenia, jednak organizm stopniowo adaptuje się do wchłaniania dzięki czemu po pewnym czasie można spożyć nawet kilkadziesiąt gramów bez złych skutków. Ponadto bakterie jelitowe mogą przetwarzać go nazbyt ochoczo doprowadzając do wzdęć.
Jak wykazują badania ze względu na to że nie jest metabolizowany przez bakterie w jamie ustnej nie przyczynia się do rozwoju próchnicy a nawet w pewnym stopniu ją hamuje wpływając na mineralizację szkliwa.
Czym więc nie jest ksylitol? Na pewno nie jest "ekstraktem z kory brzozy" - w tym przypadku producent pojechał po bandzie. Problematyczne są też reklamy opisujące, że jest otrzymywany z brzozy bez uściślenia w jaki sposób. W efekcie wielu ludzi wyobraża sobie, że występuje w drewnie, liściach lub soku i stamtąd jest po prostu wymywany, parę razy widziałem domysły, że krystalizuje się go z soku brzozowego w związku z czym sok taki propaguje się przypisując mu jego właściwości, a nawet domysły, że to po prostu wysuszony sok z brzozy (w rzeczywistości sok brzozy zawiera głownie sacharozę i glukozę[2]). W dodatku producenci skrzętnie omijają w reklamach inne źródła, jak wspomniane łodygi kukurydzy czy słoma owsiana, bo brzoza budzi lepsze skojarzenia, brzmi bardziej dziko i naturalnie.
Inny problem to reklamy opisujące że ksylitol jest składnikiem "występującym w naturze" czy wręcz "naturalnym" - faktycznie, występuje w naturze, szczególnie dużo (ok. 1%) jest go w owocach jagodowych i niektórych warzywach, ale nie stamtąd się go otrzymuje. A akurat ten sprzedawany z sklepach jest otrzymywany z drewna które go nie zawiera po dwuetapowym procesie, więc w najlepszym razie jest produktem półsyntetycznym. Niestety kult naturalności i przekonanie że wszystko co sztuczne musi być złe powodują, że dla większych zysków producenci starają się mniej lub bardziej oszukać klientów.
Jako ciekawostkę dodam na koniec, że po znitrowaniu można z ksylitolu zrobić całkiem niezły materiał wybuchowy. To tak a'propos argumentacji "to musi być złe bo ma złe zastosowania".
-------------
Źródła:
* https://en.wikipedia.org/wiki/Xylitol
* https://www.dcnutrition.com/miscellaneous/Detail.CFM?RecordNumber=695
* http://www.danisco.com/fileadmin/user_upload/danisco/documents/products/2e_XIVIA_White_Paper.pdf
[1] http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0104-66322003000300006
[2] http://luczaj.com/publikacje/2014%20Luczaj%20Bilek%20Stawarczyk.pdf
Polecam obszerny artykuł na temat ksylitolu, nie znalazłem go gdy szukałem informacji do swojego a dużo uzupełnia:
http://pinkcake.blox.pl/2015/02/Ksylitol-bialy-oczyszczony-nienaturalny.html
wtorek, 5 maja 2015
Czarne czy zielone?
Zaszedłem do sklepu aby przy okazji innych zakupów kupić też oliwki. Wybrałem słoiczek czarnych i oczywiście pierwsze co zrobiłem, to zajrzałem na masę netto i na skład. A tam oprócz soli i innych typowych składników zalewy, znalazłem też "stabilizator - glukonian żelazawy". Stabilizator czego? - zaciekawiłem się. A no stabilizator czarnej barwy.
Oliwka europejska to gatunek typowo śródziemnomorski. Jest wiecznie zielonym, niskim drzewem, często przybierającym formy krzewiaste. Za sprawą silnego systemu korzeniowego, dużej zdolności regeneracji i wolnego wzrostu może żyć długo, nawet ponad tysiąc lat. Owocem oliwki jest pestkowiec o tłustym miąższu otaczającym dużą pestkę. Większość światowych zbiorów jest przetwarzana na cenioną w kuchni oliwę, zdecydowanie mniejsza trafia na nasze stoły w formie zamarynowanej w soli lub occie.
I tutaj właśnie zaczyna się interesująca nas kwestia - owoc oliwki po zupełnym dojrzeniu ma kolor ciemnofioletowy, jednak większość oliwek zbiera się gdy są jeszcze zielone, niedojrzałe, głownie ze względu na lepszy smak. Skąd więc oliwka czarna?
Różne źródła różnie to podawały, ale wydaje się że są dwa typy - zebrane oliwki mogą być poddawane dalszej fermentacji, podczas której ciemnieją. Wydaje się jednak, że częściej poddawane są specjalnemu procesowi, polegającym na macerowaniu w alkalicznej zalewie z dodatkiem soli żelaza i przedmuchiwanej powietrzem. W alkalicznym środowisku związane polifenole w skórce oliwki ulegają uwolnieniu i mogą być utleniane przez powietrze do form ciemno zabarwionych. Sole żelaza dodatkowo tworzą z polifenolami ciemne kompleksy - opisałem to kiedyś w artykule o atramencie z dębowych galasów. W efekcie zielona oliwka staje się czarna.[1]
Identyczne procesy zachodzą podczas fermentacji, tutaj są jednak szybsze i dają równomierny kolor. Nawiasem mówiąc zielone oliwki są chronione przez dostępem powietrza aby same nie zaczęły ciemnieć - stąd zwykle zalewa zawiera kwas askorbinowy jako przeciwutleniacz.
Dodatek soli żelaza do zalewy utrwala kolor czarnych oliwek i zapobiega odbarwieniom. Ale czy wobec tego - zastanowią się niektórzy - czy przypadkiem aby taka czerniona oliwka nie jest szkodliwa? Wydaje się, że nie - sam owoc mógł wchłonąć nieco żelaza. Glukonian żelazawy jest natomiast solą nieszkodliwą - stanowi połączenie żelaza z pochodną glukozy, kwasem glukonowym. Połączenie to charakteryzuje się tym, że w takiej formie żelazo jest stosunkowo dobrze przyswajalne, stąd też używa się do w suplementach do leczenia anemii. Dopiero dość duże dawki mogą wywołać biegunki i podrażnienia, co związane jest z toksycznym działaniem samego żelaza.[2]
W anglojęzycznym internecie zauważyć można charakterystyczną pomyłkę - otóż wiele osób widząc nazwę "gluconate" sądzi, że jest to składnik zawierający gluten. A to nie prawda.
Wygląda na to, że sprzedawane w sklepach oliwki, nie są tak czarne jak to by się wydawało.
-------
[1] http://www.oliveoilsource.com/asktheexpert/are-olives-dyed-make-them-black
[2] http://en.wikipedia.org/wiki/Iron%28II%29_gluconate
Oliwka europejska to gatunek typowo śródziemnomorski. Jest wiecznie zielonym, niskim drzewem, często przybierającym formy krzewiaste. Za sprawą silnego systemu korzeniowego, dużej zdolności regeneracji i wolnego wzrostu może żyć długo, nawet ponad tysiąc lat. Owocem oliwki jest pestkowiec o tłustym miąższu otaczającym dużą pestkę. Większość światowych zbiorów jest przetwarzana na cenioną w kuchni oliwę, zdecydowanie mniejsza trafia na nasze stoły w formie zamarynowanej w soli lub occie.
I tutaj właśnie zaczyna się interesująca nas kwestia - owoc oliwki po zupełnym dojrzeniu ma kolor ciemnofioletowy, jednak większość oliwek zbiera się gdy są jeszcze zielone, niedojrzałe, głownie ze względu na lepszy smak. Skąd więc oliwka czarna?
Różne źródła różnie to podawały, ale wydaje się że są dwa typy - zebrane oliwki mogą być poddawane dalszej fermentacji, podczas której ciemnieją. Wydaje się jednak, że częściej poddawane są specjalnemu procesowi, polegającym na macerowaniu w alkalicznej zalewie z dodatkiem soli żelaza i przedmuchiwanej powietrzem. W alkalicznym środowisku związane polifenole w skórce oliwki ulegają uwolnieniu i mogą być utleniane przez powietrze do form ciemno zabarwionych. Sole żelaza dodatkowo tworzą z polifenolami ciemne kompleksy - opisałem to kiedyś w artykule o atramencie z dębowych galasów. W efekcie zielona oliwka staje się czarna.[1]
Identyczne procesy zachodzą podczas fermentacji, tutaj są jednak szybsze i dają równomierny kolor. Nawiasem mówiąc zielone oliwki są chronione przez dostępem powietrza aby same nie zaczęły ciemnieć - stąd zwykle zalewa zawiera kwas askorbinowy jako przeciwutleniacz.
Dodatek soli żelaza do zalewy utrwala kolor czarnych oliwek i zapobiega odbarwieniom. Ale czy wobec tego - zastanowią się niektórzy - czy przypadkiem aby taka czerniona oliwka nie jest szkodliwa? Wydaje się, że nie - sam owoc mógł wchłonąć nieco żelaza. Glukonian żelazawy jest natomiast solą nieszkodliwą - stanowi połączenie żelaza z pochodną glukozy, kwasem glukonowym. Połączenie to charakteryzuje się tym, że w takiej formie żelazo jest stosunkowo dobrze przyswajalne, stąd też używa się do w suplementach do leczenia anemii. Dopiero dość duże dawki mogą wywołać biegunki i podrażnienia, co związane jest z toksycznym działaniem samego żelaza.[2]
W anglojęzycznym internecie zauważyć można charakterystyczną pomyłkę - otóż wiele osób widząc nazwę "gluconate" sądzi, że jest to składnik zawierający gluten. A to nie prawda.
Wygląda na to, że sprzedawane w sklepach oliwki, nie są tak czarne jak to by się wydawało.
-------
[1] http://www.oliveoilsource.com/asktheexpert/are-olives-dyed-make-them-black
[2] http://en.wikipedia.org/wiki/Iron%28II%29_gluconate
poniedziałek, 16 lutego 2015
Chemia bardzo tłustego pączka, czyli o niemożebnie długim składzie słów kilka
Z okazji Tłustego Czwartku w mediach wypłynęła sprawa pewnych pączków, opatrzonych w sklepie niemożebnie długą listą składników. I oczywiście zaraz popłynęły komentarze "zaraz będziemy świecić", "ale syf", "tam jest cała tablica mendelejewa" czy nawet stary szlagier używany w każdej dyskusji o jedzeniu "myślicie że skąd teraz tyle chorób?".
No cóż. Odkrycie że pączek nie składa się po prostu z pączka, dla wielu może być zaskakujące, jednak wczytując się w artykuły o tym znalezisku zauważyłem, że nikt nie podał merytorycznych argumentów. Zamiast "ten pączek jest zły bo zawiera składnik X którzy szkodzi" cała argumentacja we wszystkich artykułach opiera się na stwierdzeniu "to musi być złe bo ma tak dużo składników". I dla wielu zatrzymywanie się na tym etapie jest wystarczające - na Facebookowym profilu Czytamy Etykiety omawianie składu zaczyna się od oglądania etykiety i koniec, już można komentować że syf, że złe, że można popić płynem do naczyń.
No to teraz przeprowadźmy merytoryczny rozbiór pączka na składniki.
Na początku wyjaśnienie - producent podał pełny skład produktu, ze składnikami wedle malejącego udziału z podziałem na poszczególne części. Pączek zawiera w sobie właściwe ciasto, czekoladowe nadzienie i polewę czekoladową czarną. Każda z tych składowych ma swoje własne składniki, które muszą zostać wymienione osobno, nawet jeśli się powtarzają. Z pobieżnego przeglądu można wychwycić, że w składzie wymieniającym składniki tych trzech substancji składających na pączek woda pojawia się trzy razy, utwardzone tłuszcze roślinne trzy razy, sól dwa razy, sorbinian dwa razy, cukier trzy razy, kwas cytrynowy trzy razy...
To trochę tak jakbyście chcieli sprzedawać domowe ciasteczka z dżemem i czekoladą i musieli dodać skład w którym zmuszeni byście byli wymienić nie tylko wszystkie składniki ciasta, ale jeszcze wszystkie składniki dżemu i wszystkie składniki czekolady, nawet gdy się będą powtarzać. Wtedy też wam wyjdzie bardzo długa lista.*
No ale może po kolei. Najpierw idą składniki ciasta, począwszy od mąki, aż dochodzimy do margaryny 80% i dalej wymienione mamy składniki margaryny użytej do ciasta aż do pozycji "mieszanka tokoferoli" potem znów dalsze składniki ciasta, których było mniej niż margaryny, w tym ponownie sól, aż do aromatu.
Potem idą składniki nadzienia czekoladowego, począwszy od wody a skończywszy na polisorbacie, i na koniec składniki polewy. I jeszcze lista alergenów. Rozpatrzmy więc składniki osobno:
1. Ciasto
*Mąka pszenna - jakieś zastrzeżenia?
*Masa jajowa płynna pasteryzowana - Ten tajemniczo brzmiący składnik, jest dokładnie tym co pierwsze przychodzi na myśl. To po prostu białko i żółtko zmiksowane razem i zapasteryzowane. Jak podaje na swojej stronie jeden z producentów masy, jej produkcja opiera się na następujących etapach: wybijanie świeżych jaj kurzych, filtrowanie, pasteryzacja, schładzanie [1]. Żadnych dodatków, konserwantów, barwników itp. Jakieś zastrzeżenia?
*Cukier
*Drożdże
(margaryna osobno)
*substancja konserwująca kwas sorbowy - konserwant pochodzący z owoców jarzębiny, zapobiega wzrostowi pleśni a także pałeczki jadu kiełbasianego, może wywoływać alergie na skórze natomiast nie jest szkodliwy wewnętrznie (zatem pamiętajcie - nie smarujcie się ciastem od pączka)
* regulator kwasowości kwas cytrynowy - nieszkodliwy
* barwnik annato - jest to barwnik naturalny, wyciąg z osnówek nasion Arnoty właściwej, tropikalnego krzewu z ameryki południowej, zawierający karotenoidy i terpenoidy. Pozwala uzyskać kolor od żółtego do czerwono-pomarańczowego, zwykle używany do serów, tu zapewne w śladowych ilościach dla nadania ciastu kremowego odcienia. W dużych ilościach może wywoływać alergie, dlatego normy są bardzo wyśrubowane.
* woda
*sól
* mleko w proszku
* polepszacz E 407 - Karagen, substancja żelująca otrzymywana z czerwonych krasnorostów. Głównym składnikiem jest polisacharyd o bardzo dużej ilości grup sulfonowych. Zwiększa lepkość i spowalnia sedymentację. ze względu na grupy sulfonowe może wywoływać reakcje u uczulonych na siarczyny. Jest składnikiem kontrowersyjnym - niektóre badania wskazują że ma wpływ na rozwój raka jelita grubego. Ponieważ jednak inne badania tego efektu nie wykazują, formalnie nie jest na liście kancerogenów.
* Aromat - ?
1.a Margaryna 80%
* Oleje roślinne i tłuszcze roślinne utwardzone
* woda
* emulgatory, mono i dwuglicerydy kwasów tłuszczowych - pochodna tłuszczów. Zwykłe tłuszcze składają się z gliceryny, alkoholu trójwodorotlenowego, połączonego wiązaniami estrowymi z trzema cząsteczkami kwasów tłuszczowych. W wyniku częściowej hydrolizy kwasem lub enzymem, otrzymnujemu mono gliceryd z jednym kwasem tłuszczowym i dwiema wolnymi grupami hydroksylowymi gliceryny, lub diglicerydy z dwoma kwasami tłuszczowymi.
Póki wszystkie trzy miejsca w glicerynie są zajęte, tłuszcz jest hydrofobowy, czyli niechętnie styka się i miesza z wodą. Częściowo zhydrolizowany tłuszcz z wolnymi miejscami zachowuje się inaczej - jest łatwo zwilżalny, pozwala wodzie tworzyć ścisłą warstewkę na powierzchni kropli i wchłania pewną ilość wody. Dodany do zwykłego tłuszczu ułatwia tworzenie emulsji, i dlatego jest dodany do margaryny aby się nie rozdzielała.
Takie mono i diglicerydy nie są szkodliwe. Powstają w naszych jelitach podczas trawienia tłuszczu, i w pewnym stopniu ułatwiają ten proces, właśnie przez tworzenie emulsji.
* Lecytyna - Kolejny emulgator. Naturalny fosfolipid otrzymywany albo z jaj kurzych, albo soi albo z rzepaku. W pewnym sensie jest to pochodna diglicerydów, zawierająca resztę fosforanową i cholinę. Pomaga w tworzeniu emulsji i mieszaniu tłuszczy z wodą. Nieszkodliwa, składnik naszego organizmu głównie w układzie nerwowym.
*sól 0,5%
*przeciwutleniacz palmitynian askorbylu - ta trudna chemiczna nazwa opisuje nietypowe połączenie. Jest to ester kwasu tłuszczowego, konkretnie kwasu palmitynowego, z kwasem askorbinowym, czyli witaminą C. Dzięki takiej formie witamina staje się rozpuszczalna w tłuszczach, dzięki czemu zapobiega ich utlenieniu i jełczeniu. Nieszkodliwa, podczas trawienia jest rozkładana na składowe.
* mieszanina tokoferoli - tokoferole to witamina E. Naturalna forma występująca w tłuszczach to mieszanka ośmiu podobnych związków. Są antyoksydantami wymiatającymi wolne rodniki i zapobiegającymi utlenianiu tłuszczy, stąd zastosowanie do utrwalania margaryn i majonezów.
2. Nadzienie czekoladowe
* woda
* syrop glukozowy
* cukier
* skrobia modyfikowana 2,5% - nie podano która konkretnie skrobia modyfikowana, w każdym bądź razie składnik nieszkodliwy, zagęstnik
* kakao niskotłuszczowe w proszku
* olej palmowy
* zagęstniki: celuloza E 460
* karboksymetyloceluloza E 466 - pochodna celulozy podstawiona kwasem octowym z wolną grupą karboksylową. Rozpuszczalna w wodzie, zwiększa lepkość roztworów. Nieszkodliwa, choć w dużych ilościach może powodować wzdęcia.
* karagen - już omówiony
* guma ksantanowa - produkt fermentacji węglowodanów. Zwiększa lepkość roztworów w sposób odporny na zmiany temperatur. Nieszkodliwa, choć w dużych ilościach może wywołać wzdęcia
* regulator kwasowości: lakton kwasu glukonowego. Pochodna glukozy powstająca w wyniku jej utlenienia. Lekko kwaśny, równowaga z kwasem glukonowym powoduje, że działa podobnie do bufora. Nieszkodliwy, jeden z produktów metabolizmu glukozy, przetwarzany tak samo jak ona.
*aromat - ?
* sól
* konserwant - sorbinian potasu - już omówiony
* barwnik dwutlenek tytanu - tak na prawdę pigment. nierozpuszczalny biały proszek, rozpraszający światło. Nie ulega strawieniu, wydalany, nietrujący.
* wanilina
* substancja emulgująca polisorbat 60 - inaczej monooleinian polioksyetylenosorbitolu. Połączenie sorbitolu, zwykle używanego jako słodzik, z kwasem tłuszczowym, w tym przypadku oleinowym. Z czterech grup hydroksylowych sorbitolu, jedna łączy się z kwasem tłuszczowym, zaś pozostałe mają przyłączony łańcuch polieterowy.
Takie połączenie pomaga tłuszczom tworzyć małe kropelki łączące się ze skrobią w jednolitą masę. Pomaga pęcherzykom powietrza przyklejać się do tłuszczu, stąd użycie w produktach spienionych. W lodach spowalnia rozpływanie się. Nieszkodliwy. Podczas trawienia rozpada się na sorbitol, kwasy tłuszczowe i kwas szczawiowy.
Ostatnim składnikiem z podaną ilością była skrobia modyfikowana i było jej 2,5%. Następnie mieliśmy 12 składników. Ponieważ składniki uszeregowano od największej ilości do najmniejszej polisorbatu musi być na prawdę mało.
3. Polewa o smaku czekoladowym
* Cukier
* tłuszcz roślinny częściowo utwardzony
* proszek kakaowy niskotłuszczowy 16%
*miazga kakaowa 1,3%
*emulgatory E 222 - zły numer, dodatek o tym numerze to konserwant wodorosiarczan sodu, konserwujący przetwory owocowe, chodziło zapewne o E 322 czyli lecytynę sojowa, już omówioną
*E 476 - Polirycynoleinian poliglicerolu, pochodna tłuszczu gdzie z kwasem tłuszczowym rycynolowym połączona jest spolimeryzowana gliceryna. Podczas trawienia rozpada się na glicerynę i kwas rycynolowy. U zwierząt duże dawki powiększają wątrobę, u ludzi tego nie stwierdzono. Teoretycznie powinien wywoływać przeczyszczenie po spożyciu większej ilości, ze względu na kwas rycynolowy, ten sam co w oleju rycynowym, ale chyba nie ma bo w produktach tak dużo.
Jest emulgatorem do mas stałych, wiąże tłuszcze krzepnące w temperaturze pokojowej z cząstkami skrobi i cukrem. Chętnie używany w masach czekoladowych gdzie zapobiega oddzielaniu się cząstek kakao. Używany w czekoladach niskotłuszczowych, ma bowiem właściwości podobne do masła kakaowego ale może być użyty w mniejszych ilościach
* Aromat - ?
Uff! Trochę tego było.
Po odjęciu powtarzających się składników zostaje ok. 30. Jeśli nie brać pod uwagę zwyczajnych składników ciast, a więc cukru, mąki, kakao itp.; jeśli odjąć składniki nieszkodliwe jak kwas cytrynowy, lecytyna, glukonolakton itd. to ostatecznie dyskusyjnych pozostaje tylko kilka - kwas sorbowy mogący wywoływać alergie na skórze, barwnik annato mogący wywołać alergię, kontrowersyjny karagen. Składników typowo alergicznych jak soja czy białko jaj nie liczę, bo to nie dodatki.
[Edit: Jak to się potrafi nauka szybko zmieniać. Gdy pisałem artykuł nie było wiadomo nic na temat szkodliwego wpływu emulgatorów. Tymczasem we wczorajszym numerze The Nature ukazał się artykuł o związku niektórych emulgatorów ze stanami zapalnymi jelit. Przebadane emulgatory czyli kaboksymetyloceluloza i polisorbat 80 podawane przez dłuższy czas szczurom, powodowały zmianę składu bakterii jelitowych na taki, który sprzyjał stanom zapalnym. {2}
Jak napisałem, dodatek ten może wywoływać wzdęcia w większych ilościach. Wynika to stąd że mogą go przetwarzać bakterie jelitowe, wydzielając gazy. Najwyraźniej jedne szczepy rosną w ich obecności lepiej od innych, więc gdy jedzenie z dużą ilością tych dodatków stanowi częsty składnik diety, flora bakteryjna jelit się przebudowuje. Stanowiłoby to kolejny argument za tym, aby nie zajadać się pączkami.
Jeśli mechanizm jest rzeczywiście taki, to polirycynooleinian, mono i diglicerydy oraz lecytyna nie powinny wywoływać tego efektu, nie są bowiem trawione przez bakterie jelitowe.]
Zatem teraz jeśli już dyskutować o składzie pączka, to niech to będzie dyskusja o tym czy potrzebny jest tam karagen i czy nie ma aby za dużo tłuszczu, a nie dyskusja o tym, że "to musi być szkodliwe bo ma tyle różnych składników" zupełnie jakby ludzie czytać nie umieli.
-------------
[1] http://www.basso.pl/oferta-masa-jajowa.html
{2} Chassaing, B. et al. Nature http://www.dx.doi.org/10.1038/nature14232 (2015). 25 luty
* Przykładowy przepis (stąd):
" SKŁADNIKI:
- 300g mąki pszennej,
- 150g masła temp. pokojowa,
- 60g cukru pudru,
- 2 żółtka (z wiejskich jajek),
- 1/2 buteleczki aromatu waniliowego,
- 1/2 łyżeczki sody oczyszczonej,
- szczypta soli.
DODATKOWO
- 150g dżemu agrestowego, wysokosłodzonego np. z firmy GIL,
- 100g mlecznej czekolady (jeżeli dzieci lubią lepsza gorzka;))"
Biorąc pod uwagę składniki dżemu wymienione na stronie producenta (link) i składniki czekolady mlecznej (Wedel), gdybyśmy musieli dodać etykietkę ze składnikami własnoręcznie upieczonych domowych ciastek, wyglądałaby tak:
No cóż. Odkrycie że pączek nie składa się po prostu z pączka, dla wielu może być zaskakujące, jednak wczytując się w artykuły o tym znalezisku zauważyłem, że nikt nie podał merytorycznych argumentów. Zamiast "ten pączek jest zły bo zawiera składnik X którzy szkodzi" cała argumentacja we wszystkich artykułach opiera się na stwierdzeniu "to musi być złe bo ma tak dużo składników". I dla wielu zatrzymywanie się na tym etapie jest wystarczające - na Facebookowym profilu Czytamy Etykiety omawianie składu zaczyna się od oglądania etykiety i koniec, już można komentować że syf, że złe, że można popić płynem do naczyń.
No to teraz przeprowadźmy merytoryczny rozbiór pączka na składniki.
Na początku wyjaśnienie - producent podał pełny skład produktu, ze składnikami wedle malejącego udziału z podziałem na poszczególne części. Pączek zawiera w sobie właściwe ciasto, czekoladowe nadzienie i polewę czekoladową czarną. Każda z tych składowych ma swoje własne składniki, które muszą zostać wymienione osobno, nawet jeśli się powtarzają. Z pobieżnego przeglądu można wychwycić, że w składzie wymieniającym składniki tych trzech substancji składających na pączek woda pojawia się trzy razy, utwardzone tłuszcze roślinne trzy razy, sól dwa razy, sorbinian dwa razy, cukier trzy razy, kwas cytrynowy trzy razy...
To trochę tak jakbyście chcieli sprzedawać domowe ciasteczka z dżemem i czekoladą i musieli dodać skład w którym zmuszeni byście byli wymienić nie tylko wszystkie składniki ciasta, ale jeszcze wszystkie składniki dżemu i wszystkie składniki czekolady, nawet gdy się będą powtarzać. Wtedy też wam wyjdzie bardzo długa lista.*
No ale może po kolei. Najpierw idą składniki ciasta, począwszy od mąki, aż dochodzimy do margaryny 80% i dalej wymienione mamy składniki margaryny użytej do ciasta aż do pozycji "mieszanka tokoferoli" potem znów dalsze składniki ciasta, których było mniej niż margaryny, w tym ponownie sól, aż do aromatu.
Potem idą składniki nadzienia czekoladowego, począwszy od wody a skończywszy na polisorbacie, i na koniec składniki polewy. I jeszcze lista alergenów. Rozpatrzmy więc składniki osobno:
1. Ciasto
*Mąka pszenna - jakieś zastrzeżenia?
*Masa jajowa płynna pasteryzowana - Ten tajemniczo brzmiący składnik, jest dokładnie tym co pierwsze przychodzi na myśl. To po prostu białko i żółtko zmiksowane razem i zapasteryzowane. Jak podaje na swojej stronie jeden z producentów masy, jej produkcja opiera się na następujących etapach: wybijanie świeżych jaj kurzych, filtrowanie, pasteryzacja, schładzanie [1]. Żadnych dodatków, konserwantów, barwników itp. Jakieś zastrzeżenia?
*Cukier
*Drożdże
(margaryna osobno)
*substancja konserwująca kwas sorbowy - konserwant pochodzący z owoców jarzębiny, zapobiega wzrostowi pleśni a także pałeczki jadu kiełbasianego, może wywoływać alergie na skórze natomiast nie jest szkodliwy wewnętrznie (zatem pamiętajcie - nie smarujcie się ciastem od pączka)
* regulator kwasowości kwas cytrynowy - nieszkodliwy
* barwnik annato - jest to barwnik naturalny, wyciąg z osnówek nasion Arnoty właściwej, tropikalnego krzewu z ameryki południowej, zawierający karotenoidy i terpenoidy. Pozwala uzyskać kolor od żółtego do czerwono-pomarańczowego, zwykle używany do serów, tu zapewne w śladowych ilościach dla nadania ciastu kremowego odcienia. W dużych ilościach może wywoływać alergie, dlatego normy są bardzo wyśrubowane.
* woda
*sól
* mleko w proszku
* polepszacz E 407 - Karagen, substancja żelująca otrzymywana z czerwonych krasnorostów. Głównym składnikiem jest polisacharyd o bardzo dużej ilości grup sulfonowych. Zwiększa lepkość i spowalnia sedymentację. ze względu na grupy sulfonowe może wywoływać reakcje u uczulonych na siarczyny. Jest składnikiem kontrowersyjnym - niektóre badania wskazują że ma wpływ na rozwój raka jelita grubego. Ponieważ jednak inne badania tego efektu nie wykazują, formalnie nie jest na liście kancerogenów.
* Aromat - ?
1.a Margaryna 80%
* Oleje roślinne i tłuszcze roślinne utwardzone
* woda
* emulgatory, mono i dwuglicerydy kwasów tłuszczowych - pochodna tłuszczów. Zwykłe tłuszcze składają się z gliceryny, alkoholu trójwodorotlenowego, połączonego wiązaniami estrowymi z trzema cząsteczkami kwasów tłuszczowych. W wyniku częściowej hydrolizy kwasem lub enzymem, otrzymnujemu mono gliceryd z jednym kwasem tłuszczowym i dwiema wolnymi grupami hydroksylowymi gliceryny, lub diglicerydy z dwoma kwasami tłuszczowymi.
Póki wszystkie trzy miejsca w glicerynie są zajęte, tłuszcz jest hydrofobowy, czyli niechętnie styka się i miesza z wodą. Częściowo zhydrolizowany tłuszcz z wolnymi miejscami zachowuje się inaczej - jest łatwo zwilżalny, pozwala wodzie tworzyć ścisłą warstewkę na powierzchni kropli i wchłania pewną ilość wody. Dodany do zwykłego tłuszczu ułatwia tworzenie emulsji, i dlatego jest dodany do margaryny aby się nie rozdzielała.
Takie mono i diglicerydy nie są szkodliwe. Powstają w naszych jelitach podczas trawienia tłuszczu, i w pewnym stopniu ułatwiają ten proces, właśnie przez tworzenie emulsji.
* Lecytyna - Kolejny emulgator. Naturalny fosfolipid otrzymywany albo z jaj kurzych, albo soi albo z rzepaku. W pewnym sensie jest to pochodna diglicerydów, zawierająca resztę fosforanową i cholinę. Pomaga w tworzeniu emulsji i mieszaniu tłuszczy z wodą. Nieszkodliwa, składnik naszego organizmu głównie w układzie nerwowym.
*sól 0,5%
*przeciwutleniacz palmitynian askorbylu - ta trudna chemiczna nazwa opisuje nietypowe połączenie. Jest to ester kwasu tłuszczowego, konkretnie kwasu palmitynowego, z kwasem askorbinowym, czyli witaminą C. Dzięki takiej formie witamina staje się rozpuszczalna w tłuszczach, dzięki czemu zapobiega ich utlenieniu i jełczeniu. Nieszkodliwa, podczas trawienia jest rozkładana na składowe.
* mieszanina tokoferoli - tokoferole to witamina E. Naturalna forma występująca w tłuszczach to mieszanka ośmiu podobnych związków. Są antyoksydantami wymiatającymi wolne rodniki i zapobiegającymi utlenianiu tłuszczy, stąd zastosowanie do utrwalania margaryn i majonezów.
2. Nadzienie czekoladowe
* woda
* syrop glukozowy
* cukier
* skrobia modyfikowana 2,5% - nie podano która konkretnie skrobia modyfikowana, w każdym bądź razie składnik nieszkodliwy, zagęstnik
* kakao niskotłuszczowe w proszku
* olej palmowy
* zagęstniki: celuloza E 460
* karboksymetyloceluloza E 466 - pochodna celulozy podstawiona kwasem octowym z wolną grupą karboksylową. Rozpuszczalna w wodzie, zwiększa lepkość roztworów. Nieszkodliwa, choć w dużych ilościach może powodować wzdęcia.
* karagen - już omówiony
* guma ksantanowa - produkt fermentacji węglowodanów. Zwiększa lepkość roztworów w sposób odporny na zmiany temperatur. Nieszkodliwa, choć w dużych ilościach może wywołać wzdęcia
* regulator kwasowości: lakton kwasu glukonowego. Pochodna glukozy powstająca w wyniku jej utlenienia. Lekko kwaśny, równowaga z kwasem glukonowym powoduje, że działa podobnie do bufora. Nieszkodliwy, jeden z produktów metabolizmu glukozy, przetwarzany tak samo jak ona.
*aromat - ?
* sól
* konserwant - sorbinian potasu - już omówiony
* barwnik dwutlenek tytanu - tak na prawdę pigment. nierozpuszczalny biały proszek, rozpraszający światło. Nie ulega strawieniu, wydalany, nietrujący.
* wanilina
* substancja emulgująca polisorbat 60 - inaczej monooleinian polioksyetylenosorbitolu. Połączenie sorbitolu, zwykle używanego jako słodzik, z kwasem tłuszczowym, w tym przypadku oleinowym. Z czterech grup hydroksylowych sorbitolu, jedna łączy się z kwasem tłuszczowym, zaś pozostałe mają przyłączony łańcuch polieterowy.
Takie połączenie pomaga tłuszczom tworzyć małe kropelki łączące się ze skrobią w jednolitą masę. Pomaga pęcherzykom powietrza przyklejać się do tłuszczu, stąd użycie w produktach spienionych. W lodach spowalnia rozpływanie się. Nieszkodliwy. Podczas trawienia rozpada się na sorbitol, kwasy tłuszczowe i kwas szczawiowy.
Ostatnim składnikiem z podaną ilością była skrobia modyfikowana i było jej 2,5%. Następnie mieliśmy 12 składników. Ponieważ składniki uszeregowano od największej ilości do najmniejszej polisorbatu musi być na prawdę mało.
3. Polewa o smaku czekoladowym
* Cukier
* tłuszcz roślinny częściowo utwardzony
* proszek kakaowy niskotłuszczowy 16%
*miazga kakaowa 1,3%
*emulgatory E 222 - zły numer, dodatek o tym numerze to konserwant wodorosiarczan sodu, konserwujący przetwory owocowe, chodziło zapewne o E 322 czyli lecytynę sojowa, już omówioną
*E 476 - Polirycynoleinian poliglicerolu, pochodna tłuszczu gdzie z kwasem tłuszczowym rycynolowym połączona jest spolimeryzowana gliceryna. Podczas trawienia rozpada się na glicerynę i kwas rycynolowy. U zwierząt duże dawki powiększają wątrobę, u ludzi tego nie stwierdzono. Teoretycznie powinien wywoływać przeczyszczenie po spożyciu większej ilości, ze względu na kwas rycynolowy, ten sam co w oleju rycynowym, ale chyba nie ma bo w produktach tak dużo.
Jest emulgatorem do mas stałych, wiąże tłuszcze krzepnące w temperaturze pokojowej z cząstkami skrobi i cukrem. Chętnie używany w masach czekoladowych gdzie zapobiega oddzielaniu się cząstek kakao. Używany w czekoladach niskotłuszczowych, ma bowiem właściwości podobne do masła kakaowego ale może być użyty w mniejszych ilościach
* Aromat - ?
Uff! Trochę tego było.
Po odjęciu powtarzających się składników zostaje ok. 30. Jeśli nie brać pod uwagę zwyczajnych składników ciast, a więc cukru, mąki, kakao itp.; jeśli odjąć składniki nieszkodliwe jak kwas cytrynowy, lecytyna, glukonolakton itd. to ostatecznie dyskusyjnych pozostaje tylko kilka - kwas sorbowy mogący wywoływać alergie na skórze, barwnik annato mogący wywołać alergię, kontrowersyjny karagen. Składników typowo alergicznych jak soja czy białko jaj nie liczę, bo to nie dodatki.
[Edit: Jak to się potrafi nauka szybko zmieniać. Gdy pisałem artykuł nie było wiadomo nic na temat szkodliwego wpływu emulgatorów. Tymczasem we wczorajszym numerze The Nature ukazał się artykuł o związku niektórych emulgatorów ze stanami zapalnymi jelit. Przebadane emulgatory czyli kaboksymetyloceluloza i polisorbat 80 podawane przez dłuższy czas szczurom, powodowały zmianę składu bakterii jelitowych na taki, który sprzyjał stanom zapalnym. {2}
Jak napisałem, dodatek ten może wywoływać wzdęcia w większych ilościach. Wynika to stąd że mogą go przetwarzać bakterie jelitowe, wydzielając gazy. Najwyraźniej jedne szczepy rosną w ich obecności lepiej od innych, więc gdy jedzenie z dużą ilością tych dodatków stanowi częsty składnik diety, flora bakteryjna jelit się przebudowuje. Stanowiłoby to kolejny argument za tym, aby nie zajadać się pączkami.
Jeśli mechanizm jest rzeczywiście taki, to polirycynooleinian, mono i diglicerydy oraz lecytyna nie powinny wywoływać tego efektu, nie są bowiem trawione przez bakterie jelitowe.]
Zatem teraz jeśli już dyskutować o składzie pączka, to niech to będzie dyskusja o tym czy potrzebny jest tam karagen i czy nie ma aby za dużo tłuszczu, a nie dyskusja o tym, że "to musi być szkodliwe bo ma tyle różnych składników" zupełnie jakby ludzie czytać nie umieli.
-------------
[1] http://www.basso.pl/oferta-masa-jajowa.html
{2} Chassaing, B. et al. Nature http://www.dx.doi.org/10.1038/nature14232 (2015). 25 luty
* Przykładowy przepis (stąd):
" SKŁADNIKI:
- 300g mąki pszennej,
- 150g masła temp. pokojowa,
- 60g cukru pudru,
- 2 żółtka (z wiejskich jajek),
- 1/2 buteleczki aromatu waniliowego,
- 1/2 łyżeczki sody oczyszczonej,
- szczypta soli.
DODATKOWO
- 150g dżemu agrestowego, wysokosłodzonego np. z firmy GIL,
- 100g mlecznej czekolady (jeżeli dzieci lubią lepsza gorzka;))"
Biorąc pod uwagę składniki dżemu wymienione na stronie producenta (link) i składniki czekolady mlecznej (Wedel), gdybyśmy musieli dodać etykietkę ze składnikami własnoręcznie upieczonych domowych ciastek, wyglądałaby tak:
Składrazem 24 punkty w spisie. Smacznego.
Ciasto: mąka pszenna, masło, cukier, żółtka jaj kurzych, spulchniacz wodorowęglan sodu (E 500b), wanilina, sól; Dżem agrestowy wysokosłodzony pasteryzowany: pulpa agrestowa z kawałkami owoców, cukier, kwas cytrynowy (E 330), zagęstnik pektyny (E 400); masa czekoladowa: cukier, tłuszcz kakaowy, mleko pełne w proszku, miazga kakaowa, serwatka w proszku, laktoza, białka mleka, miazga z orzechów laskowych, tłuszcz mleczny, emulgator: lecytyna sojowa, aromat. Informacja dla alergików: zawiera jaja, pszenica, białka mleka, laktoza, orzechy laskowe; może zawierać gluten, ślady soi i innych orzechów.
niedziela, 28 września 2014
Inne ciekawe związki w grzybach
Szukając materiałów do poprzedniego wpisu natykałem się także na inne informacje o chemii grzybów, które były dla mnie ciekawe, ale nie miały związku ze zmianą zabarwienia. Aby więc nie rozwlekać wtrąceniami, postanowiłem napisać osobno o tych kilku ciekawych przypadkach.
Będzie więc grzyb o zapachu curry, grzyb który leczy, porost do farbowania wełny i grzyb który za bardzo lubi pewien pierwiastek.
Lakmus
Znany początkującym chemikom papierek lakmusowy, nasączany jest jak łatwo zgadnąć lakmusem. Mało kto wie jednak, że jest to substancja naturalna, w dodatku otrzymywana z porostów. Porost Roccella tinctoria, porasta skały na wybrzeżu Atlantyku mając formę zwisającego krzaczka, trochę podobnego do chrobotka, ale o spłaszczonych gałązkach przypominając też kępkę wyschniętej trawy morskiej. Już w starożytności używany był do farbowania wełny na piękny, czerwonofioletowy kolor, stanowiąc zastępstwo dla drogiej purpury tyryjskiej. Przez pewien czas porost stanowił główne źródło utrzymania kolonii na Azorach, a dzięki uprawom zaczął występować wielu nowych krajach.
Chemicy oczywiście zainteresowali się jego własnościami, zwłaszcza iż dobrze znany był fakt, że w alkalicznych roztworach farbierskich przybierał kolor zielononiebieski, a wełna zabarwiała się zwykle na czerwono lub fioletowo. Szybko wykazano, że jest barwnikiem zmieniającym kolor od czerwonego w roztworach kwaśnych do niebieskiego w zasadowych. Mimo raczej nie zbyt szerokiego zakresu zmienności, od 4,5 do 8,2 pH, zaczął być używany jako wskaźnik. Zwykle nasącza się nim papier w dwóch odmianach: w alkalicznej, niebieskiej, służącej do wykrycia odczynu kwaśnego, i w sprotonowanej czerwonej, służącej do wykrycia zasad. Był w tym celu używany już tak dawno, że przeszedł do języka potocznego, jako określenie "oznaki własności" w odniesieniu do osób i zjawisk (rumieniec speszonej panny jest lakmusowym papierkiem niewinności).
Wyciąg z lakmusa jest pod względem chemicznym dość skomplikowaną mieszanką ponad dwudziestu związków, głównie pochodnych związków fenolowych z silnym chromoforem orseliną (7-hydroksyfenoksazon) decydującym o intensywności koloru. Kilka z tych związków wyodrębniono i nazwano, jak choćby beta hydroksyorselina:
Lakmus bywa używany jako barwnik spożywczy E 121. Podobne barwniki zawierają rosnące w Polsce porosty z rodzaju Tarczownic. [1], [2]
Wanadowy muchomor
Muchomor czerwony i kilka innych gatunków zwracają uwagę intensywnie czerwonym kolorem kapelusza. Odpowiada za to kilka barwników, głównie betaksantyny znane też jako barwniki buraka i aramantusa, a także muskaflawina (muscaflavin) będąca związkiem z siedmiokątnym pierścieniem
Bardziej interesujący jest jednak związek wykryty i w kapeluszu i w miąższu, nietypowe połączenie metaloorganiczna amawadyna (amavadin) , w której jeden jon wanadu jest połączony przez osiem koordynacji z dwiema cząsteczkami liganda hydroksyloiminodwupropionowego:
Za sprawą takiego połączenia muchomory akumulują wanad w ilościach nawet 400 razy większych niż gleba w której rosną. Zagadką pozostaje natomiast po co jest to grzybowi potrzebne. Możliwe że kompleks pełni rolę jaką w roślinach i u zwierząt pełnią peroksydazy, to jest chroni przed uszkodzeniem od wolnych rodników. Związek może być też wykorzystany w syntezie jako katalizator selektywnego utleniania nadtlenkami. [3],[4]
Uszak bzowy - grzyb leczniczy
Uszak bzowy to nie zbyt smaczny grzyb, zbudowany z galaretowatej substancji podobnej do chrząstki . Występuje cały rok, wyrastając na martwych gałązkach drzew i krzewów, chętnie zwłaszcza na bzie czarnym, sprzyjają mu chłodne warunki dlatego zbiera się go późną jesienią a nawet zimą, bo wystarczy mu kilka dni roztopów.
Jego bliskim krewniakiem jest spożywany w Azji uszak gęstowłosy, znany jako grzyb Mun.
W kulturze Europy przyjęło się nazywać uszaka "judaszowym uchem" lub "uchem żyda", takie jest zresztą dosłowne tłumaczenie nazwy łacińskiej.
Jako grzyb bez smaku był raczej dodatkiem do sosów, a ususzony i roztarty jako zagęstnik chłonący wodę dodawany był do zup. W średniowieczu był też polecany na ból gardła, przeziębienia i zapalenia. Dopiero w nowszych nam czasach pod wpływem wieści o Japończykach, uważających azjatycki gatunek za grzyba leczniczego, postanowiono przyjrzeć się właściwościom europejskiego krewniaka.
Głównym składnikiem owocnika są polisacharydy o właściwościach żelujących, ale niektóre z nich mają dodatkowe działanie biologiczne - mogą obniżać poziom cukru we krwi, poziom cholesterolu, działać przeciwzakrzepowo a niektóre badania sugerują działanie przeciwnowotworowe.[5] Więc kto wie - może niedługo będziemy się leczyć grzybami?
Mleczaj kamforowy - grzyb curry
Mleczaj kamforowy to średnio smaczny grzyb jadalny, wyróżniający się zapachem, niektórym przypominającym kamforę, innym curry, zaś źródła anglojęzyczne kojarzą go z syropem klonowym. Zapach po wysuszeniu staje się bardziej ziołowy i podobny do lubczyku, dlatego grzyb często jest po ususzeniu używany jako przyprawa.
Skąd jednak ten zapach? Na początku lat 80. student De Shazer zadał to pytanie mykologowi Williamowi Woodowi. Ten nie znając odpowiedzi, zaproponował mu to jako temat badań. Student wydzielał substancje zapachowe z grzyba, ale nie mógł znaleźć związku, z którego powstawał właściwy aromat. Gdy ukończył studia, zaintrygowany sprawą Wood zaproponował temat kolejnemu studentowi. Potem następnemu i jeszcze jednemu. Po upływie 27 lat i wymianie pięciu studentów chemia grzyba była już dobrze poznana, ale nadal nie udawało się wykryć jaki związek w grzybie zamienia się w składniki aromatu, ani jak to następuje.
Próbowano kolejno zwykłej ekstrakcji, chromatografii cieczowej i gazowej, lecz utrudnieniem był skomplikowany skład wyciągów i brak możliwości zbadania struktury podejrzanych pików. W dodatku poszukiwany związek najwyraźniej szybko ulegał przemianie i występował w preparatach w małej ilości.
Wreszcie Wood zastosował technikę mikroekstrakcji do fazy stałej.
Jest to ciekawa technika wstępnego wyodrębniania z próbek frakcji o niskim stężeniu. Do próbówki z badaną mieszaniną wpuszcza się szklaną igłę z której wysnuwa się absorbujące włókno. Pochłania ono substancje o określonych właściwościach, a więc polarne lub niepolarne, znajdujące się bądź w roztworze bądź w powietrzu nad lekko ogrzaną próbką. Pochłaniane substancje są zagęszczane we włóknie i oddzielane od reszty, dzięki czemu mieszanka w próbce wprowadzanej do chromatografu ma zdecydowanie mniej skomplikowany skład, ponadto z uwagi na małe rozmiary włókna, badane mogą być mikroskopijne ilości substancji.
Dzięki nowej technice, i zestawowi GC-MS z detektorem określającym strukturę, udało się znaleźć brakujący element - pierwszy związek, którego przemiana prowadza do powstania aromatu. Był to kwabalakton III (quabalactone III), pochodna furanu znaleziona wcześniej w kwiatach meksykańskiego drzewa Qararibea, używanego do aromatyzowania tradycyjnej wersji czekolady i ozdoby domów.
Związek jest pochodną aminofuranonu i powstaje w wyniku laktamizacji wolnych aminokwasów, zwłaszcza podczas suszenia. W kontakcie z wilgocią ulega przemianie do silnie aromatycznego sotolonu:
Sotolon jest składnikiem zapachu kozieradki, i wraz z nią przyczynia się do zapachu curry. Występuje też w lubczyku (przyprawa maggi). Zapach ziołowy w większej ilości, w małej staje się słodkawy i podobny do syropu klonowego lub palonego cukru - występuje zresztą w tych produktach na skutek przemian fruktozy. Związek jest też składnikiem zapachu Sherry oraz francuskiego żółtego wina jako skutek metabolizowania przez drożdże kwasu alfa-ketomasłowego, stąd używana czasem nazwa "lakton vin-jaune".
Powolne powstawanie sotolonu w mleczaju kamforowym sprawia, że suszony grzyb długo zachowuje aromat - Wood znajdował go nawet w 25-letnich próbkach. Za współautorów pracy o odkryciu uznał wszystkich pięciu studentów, którzy pracowali nad tym grzybem.[6][7][8]
Podgrzybek cezowy
W czasie badań napromieniowania żywności po katastrofie w Czarnobylu, polscy badacze zwrócili uwagę na pospolitego pogrzybka brunatnego, który wykazywał zaskakująco wysokie stężenia radioaktywnego cezu. W próbkach grzyba mogło być tego pierwiastka nawet piętnaście razy więcej niż w glebie na której rósł.
Dokładniejsze badania wskazały, że ta kumulacja jest wynikiem obecności w grzybie polifenolu norbadionu A, będącego brązowym pigmentem mającym wyjątkową skłonność do tworzenia kompleksów z cezem.
Połączenia te są bardzo trwałe a selektywność wiązania porównywalna jest z eterami koronowymi.[9] Związek ten ma zresztą przy okazji własności przeciwutleniacza a także w pewnym stopniu chroni komórki przed uszkodzeniem od promieniowania, ponieważ zaś mimo wszystko stwierdzone w Europie stężenia cezu nie były groźne, grzyba można spokojnie spożywać.[10]
-------
Źródła:
[1] http://de.wikipedia.org/wiki/Lackmus
[2] http://taxusbaccata.hubpages.com/hub/Dye-Plants-II-The-Atlantic-Purple-Wonder-Archil-lichen-Roccella-tinctoria
[3] Florian Stintzinga, and Willibald Schliemann, Pigments of Fly Agaric (Amanita muscaria), Z Naturforsch C. 2007 Nov-Dec;62(11-12):779-85.
[6] http://now.humboldt.edu/news/student-question-about-mushrooms-maple-syrup-odor-takes-27-years-to-answer/
[7] http://openagricola.nal.usda.gov/Record/IND44732722
[8] http://media.bostonmycologicalclub.org/pdf/Bulletin/Final612Bulletinsequence.pdf
[9] Kuad P, Schurhammer R, Maechling C, Antheaume C, Mioskowski C, Wipff G, Spiess B. (2009). "Complexation of Cs+, K+ and Na+ by norbadione A triggered by the release of a strong hydrogen bond: nature and stability of the complexes". Physical Chemistry Chemical Physics 11 (44): 10299–310.
[10] http://en.wikipedia.org/wiki/Norbadione_A
Będzie więc grzyb o zapachu curry, grzyb który leczy, porost do farbowania wełny i grzyb który za bardzo lubi pewien pierwiastek.
Lakmus
Znany początkującym chemikom papierek lakmusowy, nasączany jest jak łatwo zgadnąć lakmusem. Mało kto wie jednak, że jest to substancja naturalna, w dodatku otrzymywana z porostów. Porost Roccella tinctoria, porasta skały na wybrzeżu Atlantyku mając formę zwisającego krzaczka, trochę podobnego do chrobotka, ale o spłaszczonych gałązkach przypominając też kępkę wyschniętej trawy morskiej. Już w starożytności używany był do farbowania wełny na piękny, czerwonofioletowy kolor, stanowiąc zastępstwo dla drogiej purpury tyryjskiej. Przez pewien czas porost stanowił główne źródło utrzymania kolonii na Azorach, a dzięki uprawom zaczął występować wielu nowych krajach.
Chemicy oczywiście zainteresowali się jego własnościami, zwłaszcza iż dobrze znany był fakt, że w alkalicznych roztworach farbierskich przybierał kolor zielononiebieski, a wełna zabarwiała się zwykle na czerwono lub fioletowo. Szybko wykazano, że jest barwnikiem zmieniającym kolor od czerwonego w roztworach kwaśnych do niebieskiego w zasadowych. Mimo raczej nie zbyt szerokiego zakresu zmienności, od 4,5 do 8,2 pH, zaczął być używany jako wskaźnik. Zwykle nasącza się nim papier w dwóch odmianach: w alkalicznej, niebieskiej, służącej do wykrycia odczynu kwaśnego, i w sprotonowanej czerwonej, służącej do wykrycia zasad. Był w tym celu używany już tak dawno, że przeszedł do języka potocznego, jako określenie "oznaki własności" w odniesieniu do osób i zjawisk (rumieniec speszonej panny jest lakmusowym papierkiem niewinności).
Wyciąg z lakmusa jest pod względem chemicznym dość skomplikowaną mieszanką ponad dwudziestu związków, głównie pochodnych związków fenolowych z silnym chromoforem orseliną (7-hydroksyfenoksazon) decydującym o intensywności koloru. Kilka z tych związków wyodrębniono i nazwano, jak choćby beta hydroksyorselina:
Lakmus bywa używany jako barwnik spożywczy E 121. Podobne barwniki zawierają rosnące w Polsce porosty z rodzaju Tarczownic. [1], [2]
Wanadowy muchomor
Muchomor czerwony i kilka innych gatunków zwracają uwagę intensywnie czerwonym kolorem kapelusza. Odpowiada za to kilka barwników, głównie betaksantyny znane też jako barwniki buraka i aramantusa, a także muskaflawina (muscaflavin) będąca związkiem z siedmiokątnym pierścieniem
Bardziej interesujący jest jednak związek wykryty i w kapeluszu i w miąższu, nietypowe połączenie metaloorganiczna amawadyna (amavadin) , w której jeden jon wanadu jest połączony przez osiem koordynacji z dwiema cząsteczkami liganda hydroksyloiminodwupropionowego:
Za sprawą takiego połączenia muchomory akumulują wanad w ilościach nawet 400 razy większych niż gleba w której rosną. Zagadką pozostaje natomiast po co jest to grzybowi potrzebne. Możliwe że kompleks pełni rolę jaką w roślinach i u zwierząt pełnią peroksydazy, to jest chroni przed uszkodzeniem od wolnych rodników. Związek może być też wykorzystany w syntezie jako katalizator selektywnego utleniania nadtlenkami. [3],[4]
Uszak bzowy - grzyb leczniczy
Uszak bzowy to nie zbyt smaczny grzyb, zbudowany z galaretowatej substancji podobnej do chrząstki . Występuje cały rok, wyrastając na martwych gałązkach drzew i krzewów, chętnie zwłaszcza na bzie czarnym, sprzyjają mu chłodne warunki dlatego zbiera się go późną jesienią a nawet zimą, bo wystarczy mu kilka dni roztopów.
Jego bliskim krewniakiem jest spożywany w Azji uszak gęstowłosy, znany jako grzyb Mun.
W kulturze Europy przyjęło się nazywać uszaka "judaszowym uchem" lub "uchem żyda", takie jest zresztą dosłowne tłumaczenie nazwy łacińskiej.
Jako grzyb bez smaku był raczej dodatkiem do sosów, a ususzony i roztarty jako zagęstnik chłonący wodę dodawany był do zup. W średniowieczu był też polecany na ból gardła, przeziębienia i zapalenia. Dopiero w nowszych nam czasach pod wpływem wieści o Japończykach, uważających azjatycki gatunek za grzyba leczniczego, postanowiono przyjrzeć się właściwościom europejskiego krewniaka.
Głównym składnikiem owocnika są polisacharydy o właściwościach żelujących, ale niektóre z nich mają dodatkowe działanie biologiczne - mogą obniżać poziom cukru we krwi, poziom cholesterolu, działać przeciwzakrzepowo a niektóre badania sugerują działanie przeciwnowotworowe.[5] Więc kto wie - może niedługo będziemy się leczyć grzybami?
Mleczaj kamforowy - grzyb curry
Mleczaj kamforowy to średnio smaczny grzyb jadalny, wyróżniający się zapachem, niektórym przypominającym kamforę, innym curry, zaś źródła anglojęzyczne kojarzą go z syropem klonowym. Zapach po wysuszeniu staje się bardziej ziołowy i podobny do lubczyku, dlatego grzyb często jest po ususzeniu używany jako przyprawa.
Skąd jednak ten zapach? Na początku lat 80. student De Shazer zadał to pytanie mykologowi Williamowi Woodowi. Ten nie znając odpowiedzi, zaproponował mu to jako temat badań. Student wydzielał substancje zapachowe z grzyba, ale nie mógł znaleźć związku, z którego powstawał właściwy aromat. Gdy ukończył studia, zaintrygowany sprawą Wood zaproponował temat kolejnemu studentowi. Potem następnemu i jeszcze jednemu. Po upływie 27 lat i wymianie pięciu studentów chemia grzyba była już dobrze poznana, ale nadal nie udawało się wykryć jaki związek w grzybie zamienia się w składniki aromatu, ani jak to następuje.
Próbowano kolejno zwykłej ekstrakcji, chromatografii cieczowej i gazowej, lecz utrudnieniem był skomplikowany skład wyciągów i brak możliwości zbadania struktury podejrzanych pików. W dodatku poszukiwany związek najwyraźniej szybko ulegał przemianie i występował w preparatach w małej ilości.
Wreszcie Wood zastosował technikę mikroekstrakcji do fazy stałej.
Jest to ciekawa technika wstępnego wyodrębniania z próbek frakcji o niskim stężeniu. Do próbówki z badaną mieszaniną wpuszcza się szklaną igłę z której wysnuwa się absorbujące włókno. Pochłania ono substancje o określonych właściwościach, a więc polarne lub niepolarne, znajdujące się bądź w roztworze bądź w powietrzu nad lekko ogrzaną próbką. Pochłaniane substancje są zagęszczane we włóknie i oddzielane od reszty, dzięki czemu mieszanka w próbce wprowadzanej do chromatografu ma zdecydowanie mniej skomplikowany skład, ponadto z uwagi na małe rozmiary włókna, badane mogą być mikroskopijne ilości substancji.
Dzięki nowej technice, i zestawowi GC-MS z detektorem określającym strukturę, udało się znaleźć brakujący element - pierwszy związek, którego przemiana prowadza do powstania aromatu. Był to kwabalakton III (quabalactone III), pochodna furanu znaleziona wcześniej w kwiatach meksykańskiego drzewa Qararibea, używanego do aromatyzowania tradycyjnej wersji czekolady i ozdoby domów.
Związek jest pochodną aminofuranonu i powstaje w wyniku laktamizacji wolnych aminokwasów, zwłaszcza podczas suszenia. W kontakcie z wilgocią ulega przemianie do silnie aromatycznego sotolonu:
Sotolon jest składnikiem zapachu kozieradki, i wraz z nią przyczynia się do zapachu curry. Występuje też w lubczyku (przyprawa maggi). Zapach ziołowy w większej ilości, w małej staje się słodkawy i podobny do syropu klonowego lub palonego cukru - występuje zresztą w tych produktach na skutek przemian fruktozy. Związek jest też składnikiem zapachu Sherry oraz francuskiego żółtego wina jako skutek metabolizowania przez drożdże kwasu alfa-ketomasłowego, stąd używana czasem nazwa "lakton vin-jaune".
Powolne powstawanie sotolonu w mleczaju kamforowym sprawia, że suszony grzyb długo zachowuje aromat - Wood znajdował go nawet w 25-letnich próbkach. Za współautorów pracy o odkryciu uznał wszystkich pięciu studentów, którzy pracowali nad tym grzybem.[6][7][8]
Podgrzybek cezowy
W czasie badań napromieniowania żywności po katastrofie w Czarnobylu, polscy badacze zwrócili uwagę na pospolitego pogrzybka brunatnego, który wykazywał zaskakująco wysokie stężenia radioaktywnego cezu. W próbkach grzyba mogło być tego pierwiastka nawet piętnaście razy więcej niż w glebie na której rósł.
Dokładniejsze badania wskazały, że ta kumulacja jest wynikiem obecności w grzybie polifenolu norbadionu A, będącego brązowym pigmentem mającym wyjątkową skłonność do tworzenia kompleksów z cezem.
Połączenia te są bardzo trwałe a selektywność wiązania porównywalna jest z eterami koronowymi.[9] Związek ten ma zresztą przy okazji własności przeciwutleniacza a także w pewnym stopniu chroni komórki przed uszkodzeniem od promieniowania, ponieważ zaś mimo wszystko stwierdzone w Europie stężenia cezu nie były groźne, grzyba można spokojnie spożywać.[10]
-------
Źródła:
[1] http://de.wikipedia.org/wiki/Lackmus
[2] http://taxusbaccata.hubpages.com/hub/Dye-Plants-II-The-Atlantic-Purple-Wonder-Archil-lichen-Roccella-tinctoria
[3] Florian Stintzinga, and Willibald Schliemann, Pigments of Fly Agaric (Amanita muscaria), Z Naturforsch C. 2007 Nov-Dec;62(11-12):779-85.
[4] José A.L. da Silva , João J.R. Fraústo da Silva, Armando J.L. Pombeiro, Amavadin, a vanadium natural complex: Its role and applications, Coordination Chemistry Reviews Volume 257, Issues 15–16, August 2013, Pages 2388–2400
[5] http://en.wikipedia.org/wiki/Auricularia_auricula-judae[6] http://now.humboldt.edu/news/student-question-about-mushrooms-maple-syrup-odor-takes-27-years-to-answer/
[7] http://openagricola.nal.usda.gov/Record/IND44732722
[8] http://media.bostonmycologicalclub.org/pdf/Bulletin/Final612Bulletinsequence.pdf
[9] Kuad P, Schurhammer R, Maechling C, Antheaume C, Mioskowski C, Wipff G, Spiess B. (2009). "Complexation of Cs+, K+ and Na+ by norbadione A triggered by the release of a strong hydrogen bond: nature and stability of the complexes". Physical Chemistry Chemical Physics 11 (44): 10299–310.
[10] http://en.wikipedia.org/wiki/Norbadione_A
czwartek, 25 września 2014
Dlaczego grzyby sinieją?
Kiedyś wspomniałem o tym we wpisie na temat herbaty, widząc jednak rosnącą ilość wyszukiwań przez które czytelnicy znajdują bloga, wychodzę naprzeciw oczekiwaniom.
Przebarwianie się grzybów pod wpływem uszkodzenia czy rozkrojenia, jest zjawiskiem częstym. Zazwyczaj spotykamy się z nim u Podgrzybków i Borowików oraz innych gatunków rodzaju Boletus, obserwuje się też przebarwianie się białego soku Mleczajów. Dlatego może nas zastanowić skąd się to bierze i czy można w ten sposób odróżnić grzyb jadalny od trującego?
No, niestety zarówno pierwsza jak i druga sprawa, nie są takie proste...
To co pospolicie nazywamy grzybem, stanowi jedynie naziemną, wypuszczaną co pewien czas część grzybicznego osobnika, kryjącego się w ziemi lub drewnie w postaci pleśniowatych strzępków. Owocnik ten, spleciony z twardej tkanki, ma za zadanie rozsiewać zarodniki tworzące się zwykle pod "okapem" kapelusza i uwalniane do powietrza, aby wraz z wiatrem dotrzeć na znaczne odległości. Inne grzyby pomagają sobie wstrzykując zawiesinę zarodników do powietrza, jak choćby pospolite purchawki. Jeszcze inne wykorzystują owady, przyciągane nie miłą wonią padliny i odchodów.
Owocniki te jednakowoż nie po to są produkowane przez grzybnię, aby je jakieś dwunożne zwierzę wycięło kozikiem i zeżarło, toteż grzyby utrudniają mykożercom zadanie bądź maskując się powierzchnią kapelusza podobną do zbrązowiałych liści, bądź wytwarzając rozmaite substancje zniechęcające czy trujące.
Jednym ze sposobów zniechęcenia zwierzęcia jest brunatnienie w miejscach uszkodzonych - pociemniały owocnik wygląda mniej atrakcyjnie - stąd też wiele gatunków grzybów wykazuje tego typu zmiany barwy. Interesujące jest przy tym co właściwie zmienia barwę i w jaki sposób.
Uszkodzenie tkanki grzyba powoduje uwolnienie z wnętrza komórek enzymów degradacyjnych, wśród nich także oksydazę fenolową. Zgodnie z nazwą wywołuje ona utlenienie związków fenolowych. Powstające chinony mają zwykle ciemniejszy kolor. Ponadto połączenie chinonów z pierwotnymi polifenolami tworzy kompleksy z przeniesieniem ładunku, mające bardzo żywe kolory. Wszystkie te efekty wywołują zmianę barwy na niebieską, granatową czy wręcz czarną, ale czasem też czerwoną lub fioletową. Wszystko zależy od tego jakie polifenole są zawarte w danym grzybie.
Podobną przyczynę ma przy okazji brązowienie ziemniaków.
Rekcja zachodzi dosyć szybko:
Borowikowe
Rodzina borowikowatych jest bardzo obszerna i obfituje w grzyby smaczne i jadalne. Należą tu borowiki jak i podgrzybki (w nowszej klasyfikacji uznaje się że podgrzybki należą do tego samego rodzaju co borowik i nie stanowią osobnej grupy), ale też koźlarze, maślaczki, złotaki i bardzo nie lubiane goryczaki. Są to grzyby o rurkowatym spodzie kapelusza, podobnym do powierzchni gąbki.
Głównym czynnikiem barwiącym jest w nich brunatna atromentyna i , kwas wariegatowy (variegatic acid) będący pomarańczowym pigmentem, czy powstające z utlenienia atromentyny kwas pulwinowy i kwas wulpinowy (pulvinic acid i vulpinic acid - nazwy są przy okazji anagramami), oraz ich pochodne jak lakton pulwinon, odpowiedzialny za kolor kapelusza maślaka żółtego.
Po uszkodzeniu tkanek, ulegają one dalszemu utlenieniu, przykładowo z podobnych kwasu wariegatowego i kserokomowego (a może borowikowego?) przez utlenianie enzymatyczne powstają niebieskie chinony, a bez enzymu z tego pierwszego powstaje czerwona wariegatorubina[1] :
Wariegatorubina powstaje na przykład w zewnętrznych tkankach grzybów, przyczyniając się do ciepłego odcienia brązowego kapelusza, czy rudego podbarwienia trzonu niektórych podgrzybków. Nie znalazłem natomiast informacji co odpowiada za ciemnoczerwone przebarwienie miąższu trującego borowika szatańskiego.
Do borowików bardzo podobny jest też Piaskowiec, przy czym dla mnie interesujący jest jadalny piaskowiec modrzak, po przekrojeniu zabarwiający się na dość wyraźny niebieski kolor
Za kolor odpowiada w tym przypadku inny polifenol gyrocyjanina (gyrocyanin) o budowie podobnej do bifenyli, utleniana do jonu chinonu[2]:
Wymienione polifenole oprócz wpływu na kolor grzyba, miewają też ciekawy wpływ biologiczny - wspomniany pulwinon i jego pochodne mają działanie cytostatyczne, mogą stanowić nowe antybiotyki, ale też leki przeciwgólowe i przeciwzapalne, kwas wariegatowy to silny przeciwutleniacz.
Mleczaje
Mleczaje to rodzaj grzybów należących do rodziny gołąbkowatych. Ich charakterystyczną cechą jest mleczko wypływające z uszkodzonych miejsc, czasem zabarwione i dodatkowo zmieniające kolor podobnie jak miąższ. Przykładowo ceniony mleczaj rydz ma pomarańczowe mleczko nie zmieniające koloru i zieleniejący miąższ, lekko trujący mleczaj złocisty ma biały miąższ i mleczko, które po kilku sekundach robi się żółte.
Ich głównymi związkami barwnymi są seskwiterpenoidy zawierające cząsteczkę azulenu, ciekawego węglowodoru aromatycznego, będącego połączeniem pierścienia pentenu i heptatrienu. Cząsteczka ta nadaje im żywe barwy. Przykładowo w mleczaju czerwieniejącym, sączącym po przekrojeniu krwiste mleczko, głównym barwnikiem jest czerwona laktarowiolina (lactaroviolin) będąca aldehydem
Mleczaj świerkowy ma mleczko początkowo pomarańczowe, jednak w ciągu pół godziny staje się ciemnoczerwone by na koniec przy wysychaniu stać się zielonkawe.
Co ciekawe mleczko tego grzyba zawiera zielonkawy laktarofulwen i niebieski laktarazulenen, tych jednak początkowo nie widać. Zmiany koloru są związane z enzymatyczną przemianą nietrwałych estrów pomarańczowego dihydroazulen-1-olu, o dużej intensywności barwy, z których uwalniany jest wolny azulenol o słabszym, żółtym kolorze. Ten ulega dalszemu utlenieniu, enzymatycznemu lub nie, do pochodnych jak fioletowa laktarowiolina, żółtawy delicial czy niebieski deterrol. Mieszanka tych pochodnych, z przewagą laktarowioliny tworzy bordowy kolor. Z czasem nie żółty delicial i azulenol polimeryzują do utworzenia zielonych produktów, które wraz z cały czas obecnym niebieskim laktarazulenem dają w efekcie brudnozielony kolor wysychającego mleczka.[3]
W zasadzie tymi reakcjami można tłumaczyć wszystkie zmiany barwy. Jeśli mleczaje nie zawierają estrów azulenolu, to ich mleczko jest białe i nie zmienia koloru, jak to ma miejsce u mleczaja modrzewiowego. Jeśli je zawierają bez innych azulenów i zawierają enzym je rozbijający, to białe mleczko żółcieje, jak u mleczaja złotawego. Jeśli zawierają inne azuleny, to mleczko jest pomarańczowe i z czasem może zielenieć, jak u mleczaja rydza. Jeśli zawierają estry azulenolu i enzym je rozbijający oraz drugi enzym utleniający, to pomarańczowy sok z czasem czerwienieje, jak u mleczaja jodłowego. A jeśli zawierają estry, enzym hydrolizujący i enzym utleniający o małej aktywności, to mleczko żółcieje, czerwienieje i zielenieje.
Mam wrażenie że przydałoby się zrobić z tego tabelkę kolorów.
Omówione seskwiterpenoidy oprócz koloru, nadają też grzybom smak, często palący. Są dla grzyba obroną przed nadgryzającymi owadami, zalewanymi lepkim mleczkiem, choć często nie przeszkadza to ich larwom. Ponieważ mają budowę podobną do hormonów roślinnych, mogą być użyte do przyspieszenia kiełkowania lub do ukorzeniania roślin. Niektóre mogą przydać się jako antybiotyki, inne są testowane jako potencjalne środki przeciwnowotworowe
Próby barwne
Fakt występowania w grzybach różnych substancji barwnych, stał się podstawą dla prób chemicznych, opierających się na traktowaniu kawałków grzybów różnymi odczynnikami. Ma to znaczenie właściwie raczej dla specjalistów, pozwalając odróżniać podobne gatunki, nie ma natomiast zbyt wielkiego dla przeciętnych grzybiarzy.
Najczęściej stosowanym odczynnikiem jest roztwór wodorotlenku potasu. Ma on za zadanie wywołać zmianę barwy polifenoli o właściwościach wskaźników kwasowości i jest używany głównie do podgrzybków, w mniejszym stopniu do pieczarek. W podobnym celu stosuje się wodny roztwór amoniaku. często stosowany jest też roztwór siarczanu żelaza II tworzący z polifenolami mocno zabarwione kompleksy.
Testy te pozwalają na odróżnienie zbliżonych do siebie gatunków, ale nie mają znaczenia dla zwykłego grzybiarza. Mleczaj chrząstka czy mleczaj piekący to tak czy siak niejadalny grzyb, nawet jeden inaczej reaguje z odczynnikiem.
Pewną wartość w wątpliwych przypadkach może mieć natomiast test Meixnera wykrywający toksyny muchomora, na przykład sromotnikowego. Wykonuje się go stosunkowo prosto, jeśli oczywiście ma się pod ręką odczynnik. Kawałek grzyba kładzie się na papierze gazetowym, tak aby papier nasączył się sokiem z miąższu. Potem na ten kawałek daje się kroplę mocnego kwasu solnego i lekko ogrzewa, na przykład suszarką do włosów. W razie obecności trucizny po kilku minutach papier zabarwia się na zielonkawo-niebiesko.
Zasada działania jest ciekawa - papier na którym drukuje się gazety (ten nielakierowany) jest robiony z pulpy z której nie oddzielono ligniny. Taki papier lepiej przyjmuje tusz, ale też szybciej żółknie i kruszy się. Lignina składa się z mieszaniny cząsteczek aromatycznych i fenolowych. Pod wpływem mocnego kwasu solnego, reaguje z toksyną tworząc konglomeraty o kolorze niebieskawym. Testu nie można robić na słońcu. Wykrywa podobne do siebie amatoksyny, związki łączące pierścień peptydu z aminą z grupą indolową:
Występują w grzybach z rodzajów muchomor, czy hełmówka, oraz niektórych czubajeczkach, wywołując po spożyciu ciężkie uszkodzenie wątroby. Grupa indolowa ulega podczas testu podstawieniu przez polifenole ligniny, tworząc związki o silniejszym kolorze.[4]
Test mógłby przydać się chociażby smakoszom, chcącym spróbować jadalnych gatunków muchomora, na przykład bardzo cenionego muchomora cesarskiego czy smacznego muchomora żółtego.
Test ten może dawać fałszywe wyniki w przypadku kilku grzybów niejadalnych, a także w przypadku grzybów zawierających psylocybinę, z ugrupowaniem indolowym w cząsteczce. Powoduje to, że miłośnicy podobnych używek próbują stosować ten test do rozpoznawania grzybów halucynogennych. Ponieważ jednak większość grzybów dających tą reakcję, to grzyby trujące, zwłaszcza hełmówki wyglądające identycznie jak niektóre łysiczki, w Ameryce notuje się rocznie po kilka zgonów z powodu pomyłki tą drogą.
W ogóle niebieszczenie grzybów jest przez wielu uważane za oznakę halucynogenności. Może to wynikać stąd że jeden z najpopularniejszych takich grzybów ma niebieski kolor. Mit ten jest tak powszechny i silny w wielu krajach, że szukając czegoś na temat "bluing mushrooms" nie mogłem znaleźć nic innego jak tylko setki stron o grzybkach rekreacyjnych. Nawet gdy dopisywałem nazwę konkretnego, jadalnego grzyba to i tak wyskakiwały mi fora używkowe, na których nastolatki rozprawiały o tym, czy jeśli podgrzybek sinieje to czy wywołuje halucynacje "jak wszystkie niebieskie grzyby".
Farbowanie grzybem?
W poszukiwaniu informacji natknąłem się na ciekawy wątek. Jednym z rodzajów hobbystycznego rękodzieła jest samodzielne farbowanie tkanin. Znani są zapaleńcy stosowania urzetu, są zapaleńcy testowania na bawełnie wywaru z kory olchy, liści brzozy czy marzanki, natomiast mało znani są eksperymentatorzy próbujący farbować tkaniny grzybami i porostami.[5] A wygląda na to że potrafią osiągać na prawdę ciekawe efekty kolorystyczne:
Test na trującego grzyba?
Niestety w naszym kraju jest tak, że więcej osób grzyby zbiera niż się na nich zna. I gdy potem w domu pojawią się wątpliwości, ludzie próbują rozpoznać grzyba na podstawie zasłyszanych mitów, co czasem kończy się tragicznie. Mity tego rodzaju mają jedną wspólną cechę - opierają się na przekonaniu że wszystkie grzyby trujące mają jakąś wspólną cechę, którą można poznać wizualnie lub w inny sposób przed zjedzeniem. Tak powstają zasady w rodzaju "wszystkie trujące grzyby mają X". Tylko że grzyb od grzyba się różni.
Do najpopularniejszych należy przekonanie, że grzyba trującego nie zjadają ślimaki. Akurat to nie jest prawda, niektóre trujące grzyby zjadają nawet chętniej niż jadalne. Ślimak ma inny metabolizm i na niego pewne trucizny mogą nie działać.
Inny mit to przekonanie, że od wszystkich trujących grzybów czernieje srebro. Bierze się zapewne z podobnego mitu na temat trucizn roślinnych, mogącego mieć pewne uzasadnienie w przypadku trucizn zawierających w składzie siarkę. Grzyby niestety są w siarkę raczej ubogie a ich substancje toksyczne ze srebrem nie reagują.
Nie lepiej jest z próbowaniem na smak - na pewno można tak rozpoznać goryczaka żółciowego, który zresztą nie jest trujący tylko okropnie smakuje, ale wiele grzybów trujących nie ma niemiłego, czy palącego smaku. Sromotnik jest podobno nawet słodkawy i ma przyjemny aromat. Czubajeczka czerwonobrązowawa ma owocowy aromat i niewyczuwalny smak.
Zasadniczo najlepiej jest zbierać grzyby które się zna i nie eksperymentować.
-------
* http://www.grzyby.pl/slownik-odczynniki.htm
* http://www.mushroomexpert.com/macrochemicals.html
* Jan VELÍŠEK, Karel CEJPEK, Pigments of Higher Fungi: A Review, Czech J. Food Sci.
Vol. 29, 2011, No. 2: 87–102
* http://mycopigments.com/
[1] Bluing Components and Other Pigments Boletes, Stephen F. Nelson
Przebarwianie się grzybów pod wpływem uszkodzenia czy rozkrojenia, jest zjawiskiem częstym. Zazwyczaj spotykamy się z nim u Podgrzybków i Borowików oraz innych gatunków rodzaju Boletus, obserwuje się też przebarwianie się białego soku Mleczajów. Dlatego może nas zastanowić skąd się to bierze i czy można w ten sposób odróżnić grzyb jadalny od trującego?
No, niestety zarówno pierwsza jak i druga sprawa, nie są takie proste...
To co pospolicie nazywamy grzybem, stanowi jedynie naziemną, wypuszczaną co pewien czas część grzybicznego osobnika, kryjącego się w ziemi lub drewnie w postaci pleśniowatych strzępków. Owocnik ten, spleciony z twardej tkanki, ma za zadanie rozsiewać zarodniki tworzące się zwykle pod "okapem" kapelusza i uwalniane do powietrza, aby wraz z wiatrem dotrzeć na znaczne odległości. Inne grzyby pomagają sobie wstrzykując zawiesinę zarodników do powietrza, jak choćby pospolite purchawki. Jeszcze inne wykorzystują owady, przyciągane nie miłą wonią padliny i odchodów.
Owocniki te jednakowoż nie po to są produkowane przez grzybnię, aby je jakieś dwunożne zwierzę wycięło kozikiem i zeżarło, toteż grzyby utrudniają mykożercom zadanie bądź maskując się powierzchnią kapelusza podobną do zbrązowiałych liści, bądź wytwarzając rozmaite substancje zniechęcające czy trujące.
Jednym ze sposobów zniechęcenia zwierzęcia jest brunatnienie w miejscach uszkodzonych - pociemniały owocnik wygląda mniej atrakcyjnie - stąd też wiele gatunków grzybów wykazuje tego typu zmiany barwy. Interesujące jest przy tym co właściwie zmienia barwę i w jaki sposób.
Uszkodzenie tkanki grzyba powoduje uwolnienie z wnętrza komórek enzymów degradacyjnych, wśród nich także oksydazę fenolową. Zgodnie z nazwą wywołuje ona utlenienie związków fenolowych. Powstające chinony mają zwykle ciemniejszy kolor. Ponadto połączenie chinonów z pierwotnymi polifenolami tworzy kompleksy z przeniesieniem ładunku, mające bardzo żywe kolory. Wszystkie te efekty wywołują zmianę barwy na niebieską, granatową czy wręcz czarną, ale czasem też czerwoną lub fioletową. Wszystko zależy od tego jakie polifenole są zawarte w danym grzybie.
Podobną przyczynę ma przy okazji brązowienie ziemniaków.
Rekcja zachodzi dosyć szybko:
Borowikowe
Rodzina borowikowatych jest bardzo obszerna i obfituje w grzyby smaczne i jadalne. Należą tu borowiki jak i podgrzybki (w nowszej klasyfikacji uznaje się że podgrzybki należą do tego samego rodzaju co borowik i nie stanowią osobnej grupy), ale też koźlarze, maślaczki, złotaki i bardzo nie lubiane goryczaki. Są to grzyby o rurkowatym spodzie kapelusza, podobnym do powierzchni gąbki.
Głównym czynnikiem barwiącym jest w nich brunatna atromentyna i , kwas wariegatowy (variegatic acid) będący pomarańczowym pigmentem, czy powstające z utlenienia atromentyny kwas pulwinowy i kwas wulpinowy (pulvinic acid i vulpinic acid - nazwy są przy okazji anagramami), oraz ich pochodne jak lakton pulwinon, odpowiedzialny za kolor kapelusza maślaka żółtego.
Po uszkodzeniu tkanek, ulegają one dalszemu utlenieniu, przykładowo z podobnych kwasu wariegatowego i kserokomowego (a może borowikowego?) przez utlenianie enzymatyczne powstają niebieskie chinony, a bez enzymu z tego pierwszego powstaje czerwona wariegatorubina[1] :
Do borowików bardzo podobny jest też Piaskowiec, przy czym dla mnie interesujący jest jadalny piaskowiec modrzak, po przekrojeniu zabarwiający się na dość wyraźny niebieski kolor
Wymienione polifenole oprócz wpływu na kolor grzyba, miewają też ciekawy wpływ biologiczny - wspomniany pulwinon i jego pochodne mają działanie cytostatyczne, mogą stanowić nowe antybiotyki, ale też leki przeciwgólowe i przeciwzapalne, kwas wariegatowy to silny przeciwutleniacz.
Mleczaje
Mleczaje to rodzaj grzybów należących do rodziny gołąbkowatych. Ich charakterystyczną cechą jest mleczko wypływające z uszkodzonych miejsc, czasem zabarwione i dodatkowo zmieniające kolor podobnie jak miąższ. Przykładowo ceniony mleczaj rydz ma pomarańczowe mleczko nie zmieniające koloru i zieleniejący miąższ, lekko trujący mleczaj złocisty ma biały miąższ i mleczko, które po kilku sekundach robi się żółte.
Ich głównymi związkami barwnymi są seskwiterpenoidy zawierające cząsteczkę azulenu, ciekawego węglowodoru aromatycznego, będącego połączeniem pierścienia pentenu i heptatrienu. Cząsteczka ta nadaje im żywe barwy. Przykładowo w mleczaju czerwieniejącym, sączącym po przekrojeniu krwiste mleczko, głównym barwnikiem jest czerwona laktarowiolina (lactaroviolin) będąca aldehydem
Mleczaj świerkowy ma mleczko początkowo pomarańczowe, jednak w ciągu pół godziny staje się ciemnoczerwone by na koniec przy wysychaniu stać się zielonkawe.
Co ciekawe mleczko tego grzyba zawiera zielonkawy laktarofulwen i niebieski laktarazulenen, tych jednak początkowo nie widać. Zmiany koloru są związane z enzymatyczną przemianą nietrwałych estrów pomarańczowego dihydroazulen-1-olu, o dużej intensywności barwy, z których uwalniany jest wolny azulenol o słabszym, żółtym kolorze. Ten ulega dalszemu utlenieniu, enzymatycznemu lub nie, do pochodnych jak fioletowa laktarowiolina, żółtawy delicial czy niebieski deterrol. Mieszanka tych pochodnych, z przewagą laktarowioliny tworzy bordowy kolor. Z czasem nie żółty delicial i azulenol polimeryzują do utworzenia zielonych produktów, które wraz z cały czas obecnym niebieskim laktarazulenem dają w efekcie brudnozielony kolor wysychającego mleczka.[3]
W zasadzie tymi reakcjami można tłumaczyć wszystkie zmiany barwy. Jeśli mleczaje nie zawierają estrów azulenolu, to ich mleczko jest białe i nie zmienia koloru, jak to ma miejsce u mleczaja modrzewiowego. Jeśli je zawierają bez innych azulenów i zawierają enzym je rozbijający, to białe mleczko żółcieje, jak u mleczaja złotawego. Jeśli zawierają inne azuleny, to mleczko jest pomarańczowe i z czasem może zielenieć, jak u mleczaja rydza. Jeśli zawierają estry azulenolu i enzym je rozbijający oraz drugi enzym utleniający, to pomarańczowy sok z czasem czerwienieje, jak u mleczaja jodłowego. A jeśli zawierają estry, enzym hydrolizujący i enzym utleniający o małej aktywności, to mleczko żółcieje, czerwienieje i zielenieje.
Mam wrażenie że przydałoby się zrobić z tego tabelkę kolorów.
Omówione seskwiterpenoidy oprócz koloru, nadają też grzybom smak, często palący. Są dla grzyba obroną przed nadgryzającymi owadami, zalewanymi lepkim mleczkiem, choć często nie przeszkadza to ich larwom. Ponieważ mają budowę podobną do hormonów roślinnych, mogą być użyte do przyspieszenia kiełkowania lub do ukorzeniania roślin. Niektóre mogą przydać się jako antybiotyki, inne są testowane jako potencjalne środki przeciwnowotworowe
Próby barwne
Fakt występowania w grzybach różnych substancji barwnych, stał się podstawą dla prób chemicznych, opierających się na traktowaniu kawałków grzybów różnymi odczynnikami. Ma to znaczenie właściwie raczej dla specjalistów, pozwalając odróżniać podobne gatunki, nie ma natomiast zbyt wielkiego dla przeciętnych grzybiarzy.
Najczęściej stosowanym odczynnikiem jest roztwór wodorotlenku potasu. Ma on za zadanie wywołać zmianę barwy polifenoli o właściwościach wskaźników kwasowości i jest używany głównie do podgrzybków, w mniejszym stopniu do pieczarek. W podobnym celu stosuje się wodny roztwór amoniaku. często stosowany jest też roztwór siarczanu żelaza II tworzący z polifenolami mocno zabarwione kompleksy.
Testy te pozwalają na odróżnienie zbliżonych do siebie gatunków, ale nie mają znaczenia dla zwykłego grzybiarza. Mleczaj chrząstka czy mleczaj piekący to tak czy siak niejadalny grzyb, nawet jeden inaczej reaguje z odczynnikiem.
Pewną wartość w wątpliwych przypadkach może mieć natomiast test Meixnera wykrywający toksyny muchomora, na przykład sromotnikowego. Wykonuje się go stosunkowo prosto, jeśli oczywiście ma się pod ręką odczynnik. Kawałek grzyba kładzie się na papierze gazetowym, tak aby papier nasączył się sokiem z miąższu. Potem na ten kawałek daje się kroplę mocnego kwasu solnego i lekko ogrzewa, na przykład suszarką do włosów. W razie obecności trucizny po kilku minutach papier zabarwia się na zielonkawo-niebiesko.
Zasada działania jest ciekawa - papier na którym drukuje się gazety (ten nielakierowany) jest robiony z pulpy z której nie oddzielono ligniny. Taki papier lepiej przyjmuje tusz, ale też szybciej żółknie i kruszy się. Lignina składa się z mieszaniny cząsteczek aromatycznych i fenolowych. Pod wpływem mocnego kwasu solnego, reaguje z toksyną tworząc konglomeraty o kolorze niebieskawym. Testu nie można robić na słońcu. Wykrywa podobne do siebie amatoksyny, związki łączące pierścień peptydu z aminą z grupą indolową:
Występują w grzybach z rodzajów muchomor, czy hełmówka, oraz niektórych czubajeczkach, wywołując po spożyciu ciężkie uszkodzenie wątroby. Grupa indolowa ulega podczas testu podstawieniu przez polifenole ligniny, tworząc związki o silniejszym kolorze.[4]
Test mógłby przydać się chociażby smakoszom, chcącym spróbować jadalnych gatunków muchomora, na przykład bardzo cenionego muchomora cesarskiego czy smacznego muchomora żółtego.
Test ten może dawać fałszywe wyniki w przypadku kilku grzybów niejadalnych, a także w przypadku grzybów zawierających psylocybinę, z ugrupowaniem indolowym w cząsteczce. Powoduje to, że miłośnicy podobnych używek próbują stosować ten test do rozpoznawania grzybów halucynogennych. Ponieważ jednak większość grzybów dających tą reakcję, to grzyby trujące, zwłaszcza hełmówki wyglądające identycznie jak niektóre łysiczki, w Ameryce notuje się rocznie po kilka zgonów z powodu pomyłki tą drogą.
W ogóle niebieszczenie grzybów jest przez wielu uważane za oznakę halucynogenności. Może to wynikać stąd że jeden z najpopularniejszych takich grzybów ma niebieski kolor. Mit ten jest tak powszechny i silny w wielu krajach, że szukając czegoś na temat "bluing mushrooms" nie mogłem znaleźć nic innego jak tylko setki stron o grzybkach rekreacyjnych. Nawet gdy dopisywałem nazwę konkretnego, jadalnego grzyba to i tak wyskakiwały mi fora używkowe, na których nastolatki rozprawiały o tym, czy jeśli podgrzybek sinieje to czy wywołuje halucynacje "jak wszystkie niebieskie grzyby".
Farbowanie grzybem?
W poszukiwaniu informacji natknąłem się na ciekawy wątek. Jednym z rodzajów hobbystycznego rękodzieła jest samodzielne farbowanie tkanin. Znani są zapaleńcy stosowania urzetu, są zapaleńcy testowania na bawełnie wywaru z kory olchy, liści brzozy czy marzanki, natomiast mało znani są eksperymentatorzy próbujący farbować tkaniny grzybami i porostami.[5] A wygląda na to że potrafią osiągać na prawdę ciekawe efekty kolorystyczne:
Test na trującego grzyba?
Niestety w naszym kraju jest tak, że więcej osób grzyby zbiera niż się na nich zna. I gdy potem w domu pojawią się wątpliwości, ludzie próbują rozpoznać grzyba na podstawie zasłyszanych mitów, co czasem kończy się tragicznie. Mity tego rodzaju mają jedną wspólną cechę - opierają się na przekonaniu że wszystkie grzyby trujące mają jakąś wspólną cechę, którą można poznać wizualnie lub w inny sposób przed zjedzeniem. Tak powstają zasady w rodzaju "wszystkie trujące grzyby mają X". Tylko że grzyb od grzyba się różni.
Do najpopularniejszych należy przekonanie, że grzyba trującego nie zjadają ślimaki. Akurat to nie jest prawda, niektóre trujące grzyby zjadają nawet chętniej niż jadalne. Ślimak ma inny metabolizm i na niego pewne trucizny mogą nie działać.
Inny mit to przekonanie, że od wszystkich trujących grzybów czernieje srebro. Bierze się zapewne z podobnego mitu na temat trucizn roślinnych, mogącego mieć pewne uzasadnienie w przypadku trucizn zawierających w składzie siarkę. Grzyby niestety są w siarkę raczej ubogie a ich substancje toksyczne ze srebrem nie reagują.
Nie lepiej jest z próbowaniem na smak - na pewno można tak rozpoznać goryczaka żółciowego, który zresztą nie jest trujący tylko okropnie smakuje, ale wiele grzybów trujących nie ma niemiłego, czy palącego smaku. Sromotnik jest podobno nawet słodkawy i ma przyjemny aromat. Czubajeczka czerwonobrązowawa ma owocowy aromat i niewyczuwalny smak.
Zasadniczo najlepiej jest zbierać grzyby które się zna i nie eksperymentować.
-------
* http://www.grzyby.pl/slownik-odczynniki.htm
* http://www.mushroomexpert.com/macrochemicals.html
* Jan VELÍŠEK, Karel CEJPEK, Pigments of Higher Fungi: A Review, Czech J. Food Sci.
Vol. 29, 2011, No. 2: 87–102
* http://mycopigments.com/
[1] Bluing Components and Other Pigments Boletes, Stephen F. Nelson
[2] Helmut Besl, Andreas Bresinsky, Wolfgang Steglich, Klaus Zipfel, Pilzpigmente, XVII. Über Gyrocyanin, das blauende Prinzip des Kornblumenröhrlings (Gyroporus cyanescens), und eine oxidative Ringverengung des Atromentins, Chemische Berichte Volume 106, Issue 10, pages 3223–3229, Oktober 1973
[3] http://de.wikipedia.org/wiki/Fichten-Reizker
[4] http://www.mykoweb.com/TFWNA/P-17.html
[5] http://mushroom-collecting.com/mushroomdyeing.html
[3] http://de.wikipedia.org/wiki/Fichten-Reizker
[4] http://www.mykoweb.com/TFWNA/P-17.html
[5] http://mushroom-collecting.com/mushroomdyeing.html
czwartek, 17 kwietnia 2014
Barwniki do jaj - chemicznie ujmując
Dwa lata temu opisałem w wielkanocnym wpisie jakie są naturalne metody barwienia pisanek i jakie związki za to odpowiadają. W tym roku zatem opiszę te sztuczne barwniki.
Wprawdzie różni producenci produkują tego typu barwniki, ale jak zauważyłem, praktycznie wszyscy używają tych samych, więc opis na podstawie składu barwników które mam w domu, powinien być reprezentatywny.
Czerwony
W moim zestawie za czerwień odpowiada E 124 czyli czerwień koszenilowa. To dość skomplikowany związek:
Dwie cząsteczki pochodnych naftalenu połączone grupą azową -N=N-. Grupa ta jest silnym chromoforem, a więc ugrupowaniem nadającym barwę, a jej kolor wzmacniają duże cząsteczki aromatyczne.
Wszystkie barwniki azowe mogą wywoływać uczulenia, u osób nadwrażliwych na salicylany zwiększają objawy a u astmatyków zwiększają wydzielanie histaminy. Z tego powodu ich użycie w żywności jest coraz bardziej ograniczane a normy zawartości systematycznie obniżane.
Różowy
W niektórych zestawach kolor różowy jest otrzymywany przez dodatek amarantu czyli E-123, kolejnego barwnika azowego. Ze względu na częste doniesienia o reakcjach nadwrażliwości jest coraz rzadziej używany w przemyśle spożywczym, podbarwia kawior, galaretki w proszku i napoje alkoholowe. Jest podejrzewany o rakotwórczość ale nie potwierdzono tego u ludzi.
Żółty
W moim zestawie znajdują się dwa żółte barwniki. Pierwszy to żółcień pomarańczowa czyli E 110 o kolorze bliższym pomarańczy, także będąca barwnikiem azowym:
Podobnie jak inne tego typu związki może wywoływać uczulenia i pokrzywki, u nadwrażliwych na salicylany daje reakcję. Jest podejrzewana o rakotwórczość ale nie wykazano tego u ludzi, mimo tego wiele krajów jej nie stosuje. Używa się jej do podbarwiania słodyczy i żywności która musi być podgrzewana, jednak coraz rzadkiej. Kiedyś była często stosowana do dożółcania margaryny.
Znalazłem informację, że stężone roztwory wodne przybierają w pewnych temperaturach formę ciekłego kryształu.
Drugi barwnik to tartrazyna, czyli E 102, mająca dość ciekawą budowę:
Jest to także barwnik azowy z grupami aromatycznymi, ale także pierścieniem diazolowym. Charakteryzuje się dużą siłą barwiącą. Pojawia się w szerokiej gamie produktów, zwłaszcza napojach i słodyczach, choć w ostatnich latach jest wycofywania. Używa się jej też w kosmetykach i jako barwnika do wełny.
Może wywoływać te same problemy zdrowotne jak i pozostałe barwniki azowe - pokrzywki, uczulenia, nadwrażliwość itp ale też migreny. Wydaje się, że u pewnych ludzi występuje specyficzna nadwrażliwość konkretnie na tą substancję, także u tych którzy nie wykazują objawów na inne barwniki azowe.
Z tego co czytałem, niektóre zestawy zawierają jeszcze żółć chinolinową czyli E 104, także barwnik azowy, inne też kurkuminę.
Niebieski
Niebieskim barwnikiem jest tu błękit brylantowy, czyli E 133, nie jest to tym razem barwnik azowy:
Jednak grupy sulfonowe przy pierścieniach aromatycznych powodują, że także może wywoływać nadwrażliwość. Uważany jednak za bezpieczny z powodu bardzo nikłego wchłaniania. Jest często stosowany w napojach i słodyczach.
Możliwy do stosowania jest też indygokarmin E 132, pochodna pigmentu indygo (tego od dżinsów), kiedyś o nim pisałem. Nie jest barwnikiem azowym, nie wywołuje uczuleń i należy do najmniej szkodliwych substancji barwiących, jest bowiem bardzo szybko wydalany - na tyle szybko, że może zabarwić mocz na niebiesko.
Nie wiem natomiast czy w zestawach używa się czerni brylantowej - barwnika o intensywnym, niebiesko-fioletowym kolorze
Zielony
Mój zestaw nie zawierał żadnego specyficznego barwnika zielonego. Zielony był zapewne otrzymany ze zmieszania błękitu brylantowego i tartrazyny. W zasadzie możliwe jest użycie w niektórych zestawach E140 czyli chlorofilu lub lepiej rozpuszczalnej E 141 czyli chlorofiliny miedziowej, barwników pochodzenia naturalnego które spotykałem w zestawach barwników spożywczych do deserów.
Jak zatem widzicie, barwniki do jaj to kawał chemii. Czy wobec tego są groźne? Raczej nie - nie wnikają do wnętrza jajka, lecz pozostają związane w skorupce - a tą zdejmujemy i wyrzucamy. Jeśli zaś ktoś ma obawy to powinien od teraz pamiętać, by niezużytych barwników do jaj nie używać do innych rzeczy - a już parę razy czytałem o barwieniu nimi domowych ciast i lukrów, które się przecież spożywa w całości.
Post scriptum:
Znalazłem wynik ciekawego badania - analitycy ze Zgierza przebadali w 2009 roku komercyjne zestawy do barwienia przy pomocy chromatografii cienkowarstwowej. Wykazali, że na 9 przebadanych zestawów, trzy nie zawierały deklarowanych barwników, bądź zawierały w śladowych ilościach, a głównymi składnikami barwiącymi były barwniki do wełny, niedopuszczone do barwienia żywości. Opis badań jest dosyć przystępny:
http://zgierz.impib.pl/images/pdf/181.pdf
Wprawdzie różni producenci produkują tego typu barwniki, ale jak zauważyłem, praktycznie wszyscy używają tych samych, więc opis na podstawie składu barwników które mam w domu, powinien być reprezentatywny.
Czerwony
W moim zestawie za czerwień odpowiada E 124 czyli czerwień koszenilowa. To dość skomplikowany związek:
Dwie cząsteczki pochodnych naftalenu połączone grupą azową -N=N-. Grupa ta jest silnym chromoforem, a więc ugrupowaniem nadającym barwę, a jej kolor wzmacniają duże cząsteczki aromatyczne.
Wszystkie barwniki azowe mogą wywoływać uczulenia, u osób nadwrażliwych na salicylany zwiększają objawy a u astmatyków zwiększają wydzielanie histaminy. Z tego powodu ich użycie w żywności jest coraz bardziej ograniczane a normy zawartości systematycznie obniżane.
Różowy
W niektórych zestawach kolor różowy jest otrzymywany przez dodatek amarantu czyli E-123, kolejnego barwnika azowego. Ze względu na częste doniesienia o reakcjach nadwrażliwości jest coraz rzadziej używany w przemyśle spożywczym, podbarwia kawior, galaretki w proszku i napoje alkoholowe. Jest podejrzewany o rakotwórczość ale nie potwierdzono tego u ludzi.
Żółty
W moim zestawie znajdują się dwa żółte barwniki. Pierwszy to żółcień pomarańczowa czyli E 110 o kolorze bliższym pomarańczy, także będąca barwnikiem azowym:
Podobnie jak inne tego typu związki może wywoływać uczulenia i pokrzywki, u nadwrażliwych na salicylany daje reakcję. Jest podejrzewana o rakotwórczość ale nie wykazano tego u ludzi, mimo tego wiele krajów jej nie stosuje. Używa się jej do podbarwiania słodyczy i żywności która musi być podgrzewana, jednak coraz rzadkiej. Kiedyś była często stosowana do dożółcania margaryny.
Znalazłem informację, że stężone roztwory wodne przybierają w pewnych temperaturach formę ciekłego kryształu.
Drugi barwnik to tartrazyna, czyli E 102, mająca dość ciekawą budowę:
Jest to także barwnik azowy z grupami aromatycznymi, ale także pierścieniem diazolowym. Charakteryzuje się dużą siłą barwiącą. Pojawia się w szerokiej gamie produktów, zwłaszcza napojach i słodyczach, choć w ostatnich latach jest wycofywania. Używa się jej też w kosmetykach i jako barwnika do wełny.
Może wywoływać te same problemy zdrowotne jak i pozostałe barwniki azowe - pokrzywki, uczulenia, nadwrażliwość itp ale też migreny. Wydaje się, że u pewnych ludzi występuje specyficzna nadwrażliwość konkretnie na tą substancję, także u tych którzy nie wykazują objawów na inne barwniki azowe.
Z tego co czytałem, niektóre zestawy zawierają jeszcze żółć chinolinową czyli E 104, także barwnik azowy, inne też kurkuminę.
Niebieski
Niebieskim barwnikiem jest tu błękit brylantowy, czyli E 133, nie jest to tym razem barwnik azowy:
Jednak grupy sulfonowe przy pierścieniach aromatycznych powodują, że także może wywoływać nadwrażliwość. Uważany jednak za bezpieczny z powodu bardzo nikłego wchłaniania. Jest często stosowany w napojach i słodyczach.
Możliwy do stosowania jest też indygokarmin E 132, pochodna pigmentu indygo (tego od dżinsów), kiedyś o nim pisałem. Nie jest barwnikiem azowym, nie wywołuje uczuleń i należy do najmniej szkodliwych substancji barwiących, jest bowiem bardzo szybko wydalany - na tyle szybko, że może zabarwić mocz na niebiesko.
Nie wiem natomiast czy w zestawach używa się czerni brylantowej - barwnika o intensywnym, niebiesko-fioletowym kolorze
Zielony
Mój zestaw nie zawierał żadnego specyficznego barwnika zielonego. Zielony był zapewne otrzymany ze zmieszania błękitu brylantowego i tartrazyny. W zasadzie możliwe jest użycie w niektórych zestawach E140 czyli chlorofilu lub lepiej rozpuszczalnej E 141 czyli chlorofiliny miedziowej, barwników pochodzenia naturalnego które spotykałem w zestawach barwników spożywczych do deserów.
Jak zatem widzicie, barwniki do jaj to kawał chemii. Czy wobec tego są groźne? Raczej nie - nie wnikają do wnętrza jajka, lecz pozostają związane w skorupce - a tą zdejmujemy i wyrzucamy. Jeśli zaś ktoś ma obawy to powinien od teraz pamiętać, by niezużytych barwników do jaj nie używać do innych rzeczy - a już parę razy czytałem o barwieniu nimi domowych ciast i lukrów, które się przecież spożywa w całości.
Post scriptum:
Znalazłem wynik ciekawego badania - analitycy ze Zgierza przebadali w 2009 roku komercyjne zestawy do barwienia przy pomocy chromatografii cienkowarstwowej. Wykazali, że na 9 przebadanych zestawów, trzy nie zawierały deklarowanych barwników, bądź zawierały w śladowych ilościach, a głównymi składnikami barwiącymi były barwniki do wełny, niedopuszczone do barwienia żywości. Opis badań jest dosyć przystępny:
http://zgierz.impib.pl/images/pdf/181.pdf
wtorek, 8 kwietnia 2014
Azot Kjeldahla
Białka z jakich zbudowane są żyjące organizmy, składają się z aminokwasów, zawierających azot. Chcąc więc oznaczyć zawartość białka w pożywieniu mierzy się zazwyczaj po prostu zawartość azotu. Metodę tą wymyślił duński chemik pracujący na potrzeby browarów - zawartość białka w ziarnie przekłada się na właściwości słodu a te na jakość piwa.
Sama idea jest dosyć prosta - próbkę żywności roztwarza się w kwasie siarkowym w wysokiej temperaturze. W takich warunkach białka, skrobia i większość innych substancji ulegną zniszczeniu, zaś azot pochodzący z amin, głównie tych w białkach, ulegnie zamianie w siarczan amonu.
NR'+ H2SO4 → (NH4)2SO4 + CO2 + H2O
Po zalkalizowaniu roztworu mocną zasadą, siarczan amonu rozłoży się z wydzieleniem amoniaku:
(NH4)2SO4 + 2NaOH → Na2SO4 + 2H2O + 2NH3
Amoniak jest bardzo lotny więc podczas gotowania roztworu odparuje i wraz z parą wodną będzie skraplany w chłodnicy. Rozpuszczony w wykroplinach amoniak musi być teraz schwycony w roztworze. W tym celu skropliny wprowadza się do odbieralnika z kwasem borowym, będącym stosunkowo słabym kwasem. Zobojętnianie kwasu zmienia odczyn i kolor wskaźnika. Pochłoniętą ilość amoniaku odmiareczkowuje się kwasem. Proste.
Nie pamiętam czy sami mineralizowaliśmy próbkę prezed ćwiczeniem, chyba korzystałem z roztworu już przygotowanego. Mętna zalkalizowana próbka gotowała się cały czas:
Aparatura była skonstruowana trochę nieklasycznie:
Odbieralnikiem była zwykła kolbka z mianowanym roztworem kwasu borowego i z dodatkiem odczynnika Tashiro, czyli mieszaniny wskaźników - czerwieni i błękitu metylenowych. W miarę wykraplania amoniaku zawartośc stawała się zielona:
Aby po przemiareczkowaniu zasadą powrócić do głębokiego fioletu:
W tym przypadku azotu było niewiele.
Sama matoda jest dosyć dokładna, ale tak wyznaczoną zawartość białka mogą podwyższać inne substancje też uwalniające azot w formie soli amonowych. Znanym przykładem jest melamina, nagminnie używana przez nieuczciwych producentów do zawyżania zawartości białka w mleku lub paszach. Właśnie to było powodem niedawnego skandalu w Chinach gdzie wypuszczenie na rynek chrzczonego melaminą mleka w proszku spowodowało zatrucie tysięcy niemowląt.
sobota, 15 marca 2014
Chemik robi galaretki, czyli historia pewnego pomysłu
Pewnego razu wracając z zajęć do akademika zauważyłem w holu kolorowy plakat. Konkurs - brzmiał duży napis. Napój Nowej Generacji - dopisano poniżej. Oczywiście się zainteresowałem.
Konkurs organizowany przez uniwersytet i firmę spożywczą z Siedlec był skierowany do studentów, i kusił całkiem niezłą nagrodą pieniężną, zaś przedmiotem było wymyślenie i zaprezentowanie dodatku do napoju. To mogło by być coś w sam raz dla chemika - uznałem. I zapomniałem o sprawie. Dopiero gdy zostało kilka dni do końca terminu zgłaszania ruszyło mnie, że coś trzeba by spróbować, bo głupio by było nie wystartować.
Regulamin nie określał szczegółowo co ma być tematem konkursu - musiał być to dodatek do napojów, w formie pływających stałych cząstek lub dodatku smakowego. Tylko co też takiego wymyślić, aby było to zarazem oryginalne i łatwe do zrobienia? Pomysłów miałem od groma, jednak jednym z etapów konkursu była prezentacja wykonanego dodatku, więc takie pomysły jak błonnikowe kwiaty rozchylające płatki po położeniu na powierzchni napoju czy musujące kulki nadmuchiwane pianą po zamoknięciu, musiały pójść w odstawkę - w kuchni bym tego nie zrobił.
Plakat konkursowy nasuwał na myśl jakieś kulki, może żelowe. Faktycznie, kuchnia molekularna opierająca się na kulinarnych zastosowaniach zdobyczy nauki potrafi łatwo produkować żelowe kulki nazywane sztucznym kawiorem, z płynnym nadzieniem i twardą powłoczką. Tyle, że jeśli jest to tak znana sprawa, to wielu może wpaść na coś takiego, a przecież pomysły nie powinny się powtarzać - myślałem. Jak nie kulki to co? Po odrzuceniu kostek i trójkątów zdecydowałem się na gwiazdki.
Ale jakie? Powinny mieć ciekawy smak i coś charakterystycznego. Z ćwiczeń z rozpoznawaniem tworzyw sztucznych przez różną pływalność pamiętałem, że gdy gęstość stałego materiału jest podobna do gęstości cieczy, to unosi się on swobodnie wewnątrz cieczy. Zarazem jednak płaskie płatki materiału mają skłonność do układania się poziomo, jak opadający liść. Gdyby zatem - pomyślałem - ustawić je pionowo i równocześnie zawiesić swobodnie, to patrzący z boku na szklankę napoju widziałby dobrze kształt gwiazdki. A to już by było coś.
Jako materiał wybrałem sobie agar, głownie dlatego, że galaretka żelatynowa miewa niekiedy pewien posmak który nie każdemu pasuje, a także dlatego, że agar bardzo szybko zastyga i ma dobrą wydajność (łyżeczka na litr wody). Potem na pierwszym etapie tłumaczyłem też komisji, że taka galaretka byłaby wegetariańska na co coraz więcej osób zwraca uwagę. Tak więc gwiazdki z agaru, ale o jakim smaku? Postanowiłem spróbować czegoś nietypowego - smaku ostrego, konkretnie zaś imbiru. Smak kojarzył się z kolorem czerwonym, stąd projekt czerwonych-ostrych gwiazdek. Na podobnej zasadzie powstały inne typy: zielony-kwaśny i żółty-ananasowy. A jak z tym ustawieniem w zawieszeniu? Najprościej byłoby sprawić, że kształt będzie miał nie równo rozłożony ciężar. Postanowiłem zalewać żel tak, by z jednej strony płat był cieńszy, dzięki temu powinny się ustawiać cięższą połową w dół.
Ale miałem wrażenie, że to może być za mało. Trzeba było dodać do tego coś jeszcze, takiego fajnego, molekularnego a najlepiej chemicznego, żeby się coś działo w tej szklance. Może barwnik który nabiera koloru podczas wytrząsania w shakerze? Albo coś z zapachem? Albo może jeszcze... Pomysł który przyszedł mi do głowy na sam koniec był na tyle ciekawy, że postanowiłem zgłosić go osobno. Były to płatki galaretki, które po wrzuceniu do napoju zmieniają kolor na całkiem inny.
Wiele jest łatwo dostępnych i jadalnych substancji o właściwościach wskaźnika kwasowo-zasadowego. Większość napojów i soków owocowych ma odczyn kwaśny. Postanowiłem zatem przygotować twardą galaretkę zabarwioną takim wskaźnikiem z niewielkim dodatkiem alkalizującej sody oczyszczonej. Po wrzuceniu do napoju żel zakwaszałby się, zmieniając kolor.
Jest kilka takich kuchennych wskaźników. Najlepszym jest wywar z czerwonej kapusty, który zależnie od kwasowości przybiera kolor zielony w mocniejszych, niebieski w słabszych zasadach, w roztworach obojętnych lub lekko kwaśnych fioletowy a w kwaśnych różowy i czerwony. Płat galaretki barwionej kapustą przybierałby więc różne kolory zależnie od rodzaju napoju, stąd też jeden typ dodatku zachowując się różnie dawałby szeroki wachlarz efektów. Sami zresztą zobaczcie:
Płatki niebieskie to kolor surowego żelu o alkalicznym odczynie, różowe wyciągnąłem z soku pomarańczowego parę minut po dodaniu. Różnica koloru jest bardzo wyraźna.
Inny typ byłby zabarwiany wywarem z czarnych jagód, tutaj próbka:
Zielone płatki przed wrzuceniem, różowe po wyciągnięciu z napoju. Jeszcze inny typ byłby zabarwiany hibiskusem, który zmienia kolor w taki sam sposób.
Tak więc pomysł miałem a pierwsze próby pokazały, że się sprawdza. Teraz należało wysłać zgłoszenie. Zrobiłem to w ostatnim dniu terminu, tuż przed zamknięciem poczty i z zaaferowania wpisałem błędny adres. Tak to niestety ze mną jest że wiele robię na ostatnią chwilę, nie mogąc przedtem się zmobilizować. List jakoś jednak doszedł na miejsce i na tydzień przed pierwszym etapem, w połowie stycznia, dostałem zawiadomienie gdzie to i o której mam się prezentować. Przygotowałem prezentacje multimedialne, po czym zakasałem rękawy i zabrałem się do wyrobu. Najpierw sporządziłem wywar ze świeżego imbiru, a gdy był dostatecznie szczypiący, dodałem torebkę herbaty hibiskusowej. Gdy się naciągnęła dosypałem agaru.
Agar kupiłem w sklepie ze zdrową żywnością. Miał postać kremowego proszku bez smaku, nie rozpuszczalnego w zimnej wodzie i powoli w gorącej.
Następnie wylałem roztwór na plastikowy talerzyk, lekko go przechylając. Żel zastygł w krótkim czasie, praktycznie zaraz po ochłodzeniu, dzięki czemu w jeden wieczór wykonałem kilka prób z różnym składem.
W zasadzie największy problem sprawiło mi wycięcie gwiazdki, nie mam bowiem zbyt dużych zdolności manualnych, jakoś sobie jednak poradziłem.
W podobny sposób zrobiłem żel zabarwiany kapustą, tylko bez imbiru. Ciekawe zresztą jak czuły okazał się wskaźnik - barwa zmieniała się po dodaniu cukru, zawierającego alkaliczne domieszki, jak i po dodaniu agaru, będącego substancją lekko kwaśną (agar zawiera 0,3% grup sulfonowych i stanowi naturalny kationit). Małe próbki zapakowałem w pojemniki aby pokazać na pierwszym etapie.
Jak to wyglądało? Całkiem spokojnie, wręcz kameralnie. Uczestnicy, których było około dziesięciu, po kolei prezentowali się przed komisją w pustej sali. Następnie powiedziano nam że w razie czego dostaniemy informację i tyle. W sumie podszedłem do tego na luzie. Więc czekałem.
Informacja o drugim, finałowym etapie, pojawiła pod koniec lutego. Termin wyznaczono na 11 marca, do finału zakwalifikowało się pięć osób, w tym ja. Fajnie. Przygotowywałem się przez ten czas, a w przeddzień, oczywiście bardzo późną nocą więc na ostatnią chwilę, przygotowałem jeszcze raz gwiazdki i zmiennobarwne płatki.
Z gwiazdkami był zresztą problem. Gdy w kuchni dobierałem dla nich gęstość, miałem na podorędziu jeden sok, nieco mętny, przez co efekt był słabo widoczny:
Więc idąc na konkurs kupiłem drugi sok, przezroczysty. Był też jednak gęstszy i gwiazdki w nim pływały po wierzchu. Musiałem rozcieńczyć. Od przygotowania stanowiska do właściwej prezentacji pomysłu minęła prawie godzina, przez ten czas gwiazdki straciły część barwnika, zarazem wchłaniając z napoju więcej cukru i teraz dla odmiany opadły na dno. Musiałem więc odlewać i dolewać żeby złapać gęstość dzięki której unosiły się swobodnie pośrodku szklanki
Jak wyglądały prezentacje innych? Pozostali uczestnicy właściwie skupili się na wymyśleniu nowego napoju a nie dodatku. Martyna Chromińska studiująca dietetykę zaproponowała ciekawy sok warzywny, zawierający głownie buraka ćwikłowego i słodzony wyciągiem ze Stewii, który jest znacznie bardziej słodszy od cukru, nie dorzucając jednak kalorii. Takie połączenie było więc zarówno smacznie dzięki słodyczy zabijającej ziemiste posmaki warzyw, ale zarazem bez cukru, stanowiąc bardzo dobry pomysł.
Bardzo dobra była też propozycja Joanny Szczepańskiej z pedagogiki, aby stworzyć koktajl warzywno-owocowy, zawierający brokuły, ale też jabłko, marchewkę, szpinak i sok pomarańczowy, dając tym samym nietypowe połączenie. Na tym etapie konkursu należało zareklamować produkt przed publicznością, nijako sprzedać swój pomysł, kiedy więc na swej prezentacji opisała jak to podczas praktyk w przedszkolu wpadła na pomysł aby dzieci zjadały więcej warzyw, gdy opisała jak to mali wychowankowie po kilku łyczkach zielonego napoju prosili o więcej i gdy wreszcie próbowała włączyć filmik pokazujący z jaką radością i ochotą dzieci wypijają unikalną mieszankę ze zmiksowanymi brokułami - szczerze mówiąc aż skręcało mnie w środku bo prezentowało się to bardzo dobrze i obawiałem się, czy aby ta propozycja nie będzie tą najlepszą.
Kolejny był pomysł matematyczki Barbry Rozwadowskiej, polegający na nalewaniu syropu miętowego na dno szklanki ze Sprite i dodawaniu kolorowej posypki. Cząstki posypki opadały aż do granicy faz, pojawiały się na nich pęcherzyki gazu, które podnosiły je do góry. W ten sposób w szklance następowała ciągła cyrkulacja kolorowych cząstek. Piąta uczestniczka z trzema propozycjami nie przyszła, nie wiem nawet jakie były jej pomysły.
Po prezentacji obejrzeliśmy krótki dokument na temat sponsorującej konkurs firmy spożywczej, potem wysłuchaliśmy krótkiego wykładu pani profesor Chruściel o nanocząstkach w żywności, az przyszło do ogłoszenia wyników.
Piąte miejsce zajął pomysł napoju ze stewią, dla pocieszenia uczestniczka dostała nagrodę publiczności. Czwarte miejsce dostał napój z kolorowa posypką. Trzecie miejsce... Nie chcę wyjść na samochwała, ale trzecie miejsce otrzymałem ja, za pomysł zmiennobarwnych płatków.
Drugie miejsce zdobył tak zachwalany pomysł napoju brokułowego, tymczasem jeśli chodzi o pierwsze, to tu się zdziwiłem - pięć miejsc i tylko czterech uczestników? Czyżby zatem... I choć wydawało się to niemożliwe, pierwsze miejsce zająłem ja. Czego jak czego ale dwóch nagród się nie spodziewałem.
W sumie trochę zaskakujące że najbardziej spodobały się gwiazdki a mniej zmiennobarwne kwadraciki, gdy tymczasem to z tymi drugimi wiązałem większe nadzieje.
I co dalej? Cóż, ja odbiorę nagrodę zaś prawa do produkcji przejmie firma i być może wdroży, kto wie zatem czy za jakiś czas nie zobaczycie w sklepach czegoś co zaprojektowałem.Dwa lata temu w konkursie wygrała propozycja jogurtu z suszonymi pomidorami i podobno niedługo ma być wypuszczony na rynek.
Konkurs organizowany przez uniwersytet i firmę spożywczą z Siedlec był skierowany do studentów, i kusił całkiem niezłą nagrodą pieniężną, zaś przedmiotem było wymyślenie i zaprezentowanie dodatku do napoju. To mogło by być coś w sam raz dla chemika - uznałem. I zapomniałem o sprawie. Dopiero gdy zostało kilka dni do końca terminu zgłaszania ruszyło mnie, że coś trzeba by spróbować, bo głupio by było nie wystartować.
Regulamin nie określał szczegółowo co ma być tematem konkursu - musiał być to dodatek do napojów, w formie pływających stałych cząstek lub dodatku smakowego. Tylko co też takiego wymyślić, aby było to zarazem oryginalne i łatwe do zrobienia? Pomysłów miałem od groma, jednak jednym z etapów konkursu była prezentacja wykonanego dodatku, więc takie pomysły jak błonnikowe kwiaty rozchylające płatki po położeniu na powierzchni napoju czy musujące kulki nadmuchiwane pianą po zamoknięciu, musiały pójść w odstawkę - w kuchni bym tego nie zrobił.
Plakat konkursowy nasuwał na myśl jakieś kulki, może żelowe. Faktycznie, kuchnia molekularna opierająca się na kulinarnych zastosowaniach zdobyczy nauki potrafi łatwo produkować żelowe kulki nazywane sztucznym kawiorem, z płynnym nadzieniem i twardą powłoczką. Tyle, że jeśli jest to tak znana sprawa, to wielu może wpaść na coś takiego, a przecież pomysły nie powinny się powtarzać - myślałem. Jak nie kulki to co? Po odrzuceniu kostek i trójkątów zdecydowałem się na gwiazdki.
Ale jakie? Powinny mieć ciekawy smak i coś charakterystycznego. Z ćwiczeń z rozpoznawaniem tworzyw sztucznych przez różną pływalność pamiętałem, że gdy gęstość stałego materiału jest podobna do gęstości cieczy, to unosi się on swobodnie wewnątrz cieczy. Zarazem jednak płaskie płatki materiału mają skłonność do układania się poziomo, jak opadający liść. Gdyby zatem - pomyślałem - ustawić je pionowo i równocześnie zawiesić swobodnie, to patrzący z boku na szklankę napoju widziałby dobrze kształt gwiazdki. A to już by było coś.
Jako materiał wybrałem sobie agar, głownie dlatego, że galaretka żelatynowa miewa niekiedy pewien posmak który nie każdemu pasuje, a także dlatego, że agar bardzo szybko zastyga i ma dobrą wydajność (łyżeczka na litr wody). Potem na pierwszym etapie tłumaczyłem też komisji, że taka galaretka byłaby wegetariańska na co coraz więcej osób zwraca uwagę. Tak więc gwiazdki z agaru, ale o jakim smaku? Postanowiłem spróbować czegoś nietypowego - smaku ostrego, konkretnie zaś imbiru. Smak kojarzył się z kolorem czerwonym, stąd projekt czerwonych-ostrych gwiazdek. Na podobnej zasadzie powstały inne typy: zielony-kwaśny i żółty-ananasowy. A jak z tym ustawieniem w zawieszeniu? Najprościej byłoby sprawić, że kształt będzie miał nie równo rozłożony ciężar. Postanowiłem zalewać żel tak, by z jednej strony płat był cieńszy, dzięki temu powinny się ustawiać cięższą połową w dół.
Ale miałem wrażenie, że to może być za mało. Trzeba było dodać do tego coś jeszcze, takiego fajnego, molekularnego a najlepiej chemicznego, żeby się coś działo w tej szklance. Może barwnik który nabiera koloru podczas wytrząsania w shakerze? Albo coś z zapachem? Albo może jeszcze... Pomysł który przyszedł mi do głowy na sam koniec był na tyle ciekawy, że postanowiłem zgłosić go osobno. Były to płatki galaretki, które po wrzuceniu do napoju zmieniają kolor na całkiem inny.
Wiele jest łatwo dostępnych i jadalnych substancji o właściwościach wskaźnika kwasowo-zasadowego. Większość napojów i soków owocowych ma odczyn kwaśny. Postanowiłem zatem przygotować twardą galaretkę zabarwioną takim wskaźnikiem z niewielkim dodatkiem alkalizującej sody oczyszczonej. Po wrzuceniu do napoju żel zakwaszałby się, zmieniając kolor.
Jest kilka takich kuchennych wskaźników. Najlepszym jest wywar z czerwonej kapusty, który zależnie od kwasowości przybiera kolor zielony w mocniejszych, niebieski w słabszych zasadach, w roztworach obojętnych lub lekko kwaśnych fioletowy a w kwaśnych różowy i czerwony. Płat galaretki barwionej kapustą przybierałby więc różne kolory zależnie od rodzaju napoju, stąd też jeden typ dodatku zachowując się różnie dawałby szeroki wachlarz efektów. Sami zresztą zobaczcie:
Inny typ byłby zabarwiany wywarem z czarnych jagód, tutaj próbka:
Zielone płatki przed wrzuceniem, różowe po wyciągnięciu z napoju. Jeszcze inny typ byłby zabarwiany hibiskusem, który zmienia kolor w taki sam sposób.
Tak więc pomysł miałem a pierwsze próby pokazały, że się sprawdza. Teraz należało wysłać zgłoszenie. Zrobiłem to w ostatnim dniu terminu, tuż przed zamknięciem poczty i z zaaferowania wpisałem błędny adres. Tak to niestety ze mną jest że wiele robię na ostatnią chwilę, nie mogąc przedtem się zmobilizować. List jakoś jednak doszedł na miejsce i na tydzień przed pierwszym etapem, w połowie stycznia, dostałem zawiadomienie gdzie to i o której mam się prezentować. Przygotowałem prezentacje multimedialne, po czym zakasałem rękawy i zabrałem się do wyrobu. Najpierw sporządziłem wywar ze świeżego imbiru, a gdy był dostatecznie szczypiący, dodałem torebkę herbaty hibiskusowej. Gdy się naciągnęła dosypałem agaru.
Agar kupiłem w sklepie ze zdrową żywnością. Miał postać kremowego proszku bez smaku, nie rozpuszczalnego w zimnej wodzie i powoli w gorącej.
Następnie wylałem roztwór na plastikowy talerzyk, lekko go przechylając. Żel zastygł w krótkim czasie, praktycznie zaraz po ochłodzeniu, dzięki czemu w jeden wieczór wykonałem kilka prób z różnym składem.
W zasadzie największy problem sprawiło mi wycięcie gwiazdki, nie mam bowiem zbyt dużych zdolności manualnych, jakoś sobie jednak poradziłem.
W podobny sposób zrobiłem żel zabarwiany kapustą, tylko bez imbiru. Ciekawe zresztą jak czuły okazał się wskaźnik - barwa zmieniała się po dodaniu cukru, zawierającego alkaliczne domieszki, jak i po dodaniu agaru, będącego substancją lekko kwaśną (agar zawiera 0,3% grup sulfonowych i stanowi naturalny kationit). Małe próbki zapakowałem w pojemniki aby pokazać na pierwszym etapie.
Jak to wyglądało? Całkiem spokojnie, wręcz kameralnie. Uczestnicy, których było około dziesięciu, po kolei prezentowali się przed komisją w pustej sali. Następnie powiedziano nam że w razie czego dostaniemy informację i tyle. W sumie podszedłem do tego na luzie. Więc czekałem.
Informacja o drugim, finałowym etapie, pojawiła pod koniec lutego. Termin wyznaczono na 11 marca, do finału zakwalifikowało się pięć osób, w tym ja. Fajnie. Przygotowywałem się przez ten czas, a w przeddzień, oczywiście bardzo późną nocą więc na ostatnią chwilę, przygotowałem jeszcze raz gwiazdki i zmiennobarwne płatki.
Z gwiazdkami był zresztą problem. Gdy w kuchni dobierałem dla nich gęstość, miałem na podorędziu jeden sok, nieco mętny, przez co efekt był słabo widoczny:
Więc idąc na konkurs kupiłem drugi sok, przezroczysty. Był też jednak gęstszy i gwiazdki w nim pływały po wierzchu. Musiałem rozcieńczyć. Od przygotowania stanowiska do właściwej prezentacji pomysłu minęła prawie godzina, przez ten czas gwiazdki straciły część barwnika, zarazem wchłaniając z napoju więcej cukru i teraz dla odmiany opadły na dno. Musiałem więc odlewać i dolewać żeby złapać gęstość dzięki której unosiły się swobodnie pośrodku szklanki
Jak wyglądały prezentacje innych? Pozostali uczestnicy właściwie skupili się na wymyśleniu nowego napoju a nie dodatku. Martyna Chromińska studiująca dietetykę zaproponowała ciekawy sok warzywny, zawierający głownie buraka ćwikłowego i słodzony wyciągiem ze Stewii, który jest znacznie bardziej słodszy od cukru, nie dorzucając jednak kalorii. Takie połączenie było więc zarówno smacznie dzięki słodyczy zabijającej ziemiste posmaki warzyw, ale zarazem bez cukru, stanowiąc bardzo dobry pomysł.
Bardzo dobra była też propozycja Joanny Szczepańskiej z pedagogiki, aby stworzyć koktajl warzywno-owocowy, zawierający brokuły, ale też jabłko, marchewkę, szpinak i sok pomarańczowy, dając tym samym nietypowe połączenie. Na tym etapie konkursu należało zareklamować produkt przed publicznością, nijako sprzedać swój pomysł, kiedy więc na swej prezentacji opisała jak to podczas praktyk w przedszkolu wpadła na pomysł aby dzieci zjadały więcej warzyw, gdy opisała jak to mali wychowankowie po kilku łyczkach zielonego napoju prosili o więcej i gdy wreszcie próbowała włączyć filmik pokazujący z jaką radością i ochotą dzieci wypijają unikalną mieszankę ze zmiksowanymi brokułami - szczerze mówiąc aż skręcało mnie w środku bo prezentowało się to bardzo dobrze i obawiałem się, czy aby ta propozycja nie będzie tą najlepszą.
Kolejny był pomysł matematyczki Barbry Rozwadowskiej, polegający na nalewaniu syropu miętowego na dno szklanki ze Sprite i dodawaniu kolorowej posypki. Cząstki posypki opadały aż do granicy faz, pojawiały się na nich pęcherzyki gazu, które podnosiły je do góry. W ten sposób w szklance następowała ciągła cyrkulacja kolorowych cząstek. Piąta uczestniczka z trzema propozycjami nie przyszła, nie wiem nawet jakie były jej pomysły.
Po prezentacji obejrzeliśmy krótki dokument na temat sponsorującej konkurs firmy spożywczej, potem wysłuchaliśmy krótkiego wykładu pani profesor Chruściel o nanocząstkach w żywności, az przyszło do ogłoszenia wyników.
Piąte miejsce zajął pomysł napoju ze stewią, dla pocieszenia uczestniczka dostała nagrodę publiczności. Czwarte miejsce dostał napój z kolorowa posypką. Trzecie miejsce... Nie chcę wyjść na samochwała, ale trzecie miejsce otrzymałem ja, za pomysł zmiennobarwnych płatków.
Drugie miejsce zdobył tak zachwalany pomysł napoju brokułowego, tymczasem jeśli chodzi o pierwsze, to tu się zdziwiłem - pięć miejsc i tylko czterech uczestników? Czyżby zatem... I choć wydawało się to niemożliwe, pierwsze miejsce zająłem ja. Czego jak czego ale dwóch nagród się nie spodziewałem.
W sumie trochę zaskakujące że najbardziej spodobały się gwiazdki a mniej zmiennobarwne kwadraciki, gdy tymczasem to z tymi drugimi wiązałem większe nadzieje.
I co dalej? Cóż, ja odbiorę nagrodę zaś prawa do produkcji przejmie firma i być może wdroży, kto wie zatem czy za jakiś czas nie zobaczycie w sklepach czegoś co zaprojektowałem.Dwa lata temu w konkursie wygrała propozycja jogurtu z suszonymi pomidorami i podobno niedługo ma być wypuszczony na rynek.
Subskrybuj:
Posty (Atom)